Иванова Елена Александровна, к.м.н., доцент кафедры морфологии медико-биологического факультета РНИМУ им. Н.И. Пирогова, член научного медицинского общества анатомов, гистологов и эмбриологов, Москва
Груздев Денис Анатольевич, руководитель Северо-Западного медицинского учебного центра последипломного образования, президент Ассоциации нитевых имплантологов, руководитель и учредитель сети клиник «Клиника доктора Груздева», Санкт-Петербург
Нитевой лифтинг (нитевая подтяжка, тредлифтинг) – популярный современный метод омоложения и коррекции эстетических дефектов.
Для пациента ожидаемый результат достигается за один сеанс, установка нитей занимает мало времени, сравнительно безболезненна, при этом эффект после нитевой имплантологии имеет длительность от полутора до пяти лет и носит кумулятивный характер. С помощью современных нитей осуществляется не только коррекция контуров лица и шеи, но и рук, ног, живота и ягодиц. В арсенале врачей-косметологов помимо армирующих, биостимулирующих и лифтинговых нитей имеются и другие виды нитей:
• филлерные нити, позволяющие получить волюмизирующий эффект при коррекции складок и морщин;
• липолитические нити, способствующие расщеплению жировой ткани в местах установки (подбородочная область, область живота, ягодиц, бедер, передняя поверхность коленного сустава);
• лечебные нити, в составе которых присутствуют компоненты, направленные на лечение дерматологических заболеваний, таких как акне или алопеция [1].
Для врачей эстетической медицины метод нитевой имплантологии привлекателен из-за простоты применения и быстрого достижения требуемого результата. Но кажущаяся простота может привести к серьезным негативным последствиям. Для успешной работы имплантологу необходимо знание анатомических аспектов, понимание того, в какие слои кожи вводятся нити, за счет каких структур и каким образом достигается подтяжка мягких тканей лица.
Основной слой, с которым работает специалист, выполняя нитевой лифтинг, – это гиподерма, или субдермальный жировой слой [1–3]. Однако в доступной литературе мы не нашли сведений о том, как реагирует иммунная система кожи,
или SIS (skin immune system), и в частности гиподерма, на введение того или иного типа нитей, за счет чего достигается тот или иной эстетический эффект и в какие сроки могут возникать те или иные осложнения. Целью нашего обзора стало
исследование иммунологической реакции гиподермы на введение чужеродного тела – нити. Поэтому в нашей статье мы рассмотрим следующие аспекты: во-первых, строение и функции ткани, в которой находится имплантат, и, во-вторых,
реакцию на него иммунокомпетентных клеток кожи в разные временные промежутки от проведения процедуры.
Строение гиподермы и ее функции с точки зрения нитевой имплантологии
В гиподерме основную часть объема жировой ткани занимают адипоциты, по разным оценкам, они составляют до 60% числа ее клеток. Остальная часть приходится на клетки-предшественники адипоцитов – фибробласты на разных стадиях дифференцировки, оседлые и мигрирующие макрофаги и клетки белой крови [7]. Существует феномен «градиента фенотипов фибробластов» – чем дальше они располагаются от эпидермиса, тем больше их фенотип похож на аналогичную характеристику жировых клеток адипоцитов, представленных в гиподерме, такие клетки получили название «липофибробласты». Благодаря их способности дифференцироваться в адипоциты происходит самообновление жировой ткани [19].
Подкожно-жировой слой – основное место приложения нитей. При проведении нити глубже, в активный мышечный слой, существует вероятность, что она порвется или переместится, что может стать причиной асимметрии лица, контурирования нити, динамической боли, а также повреждения нижележащих сосудов и нервов (рис. 1) [4].
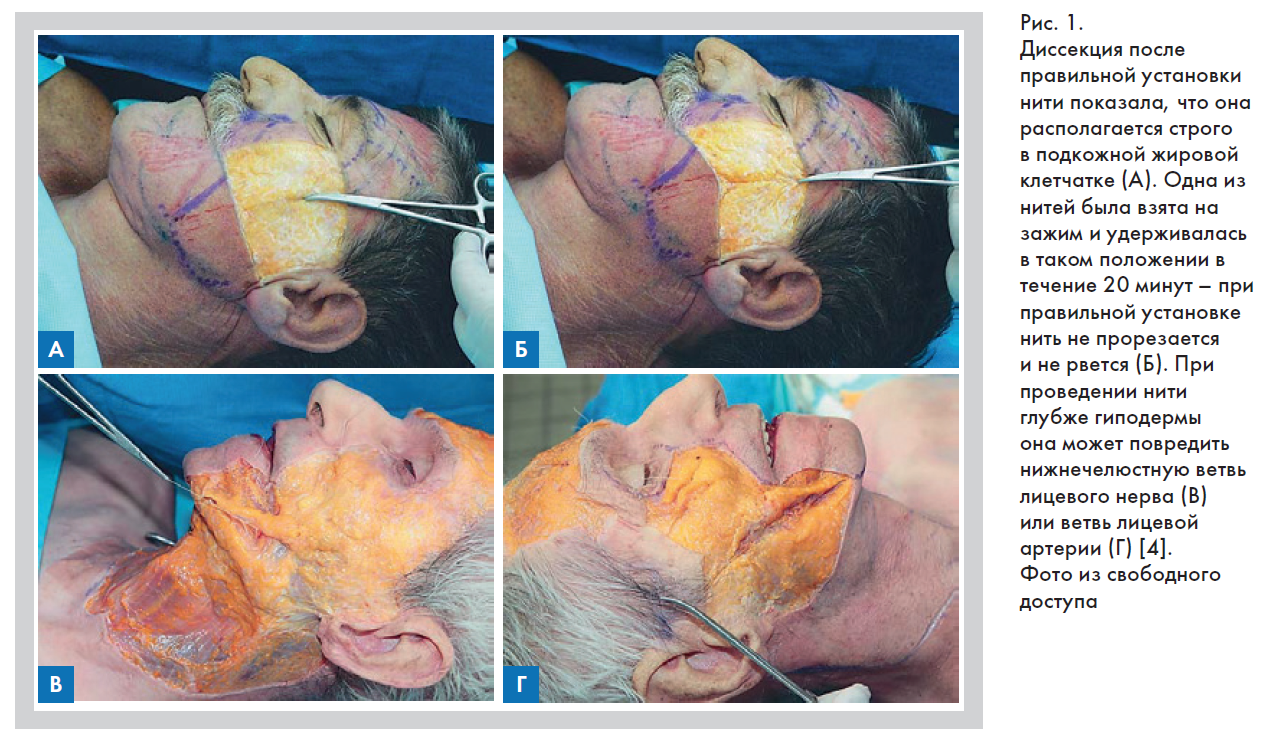
Подкожная клетчатка (гиподерма) образована кластерами жировой ткани с прослойками рыхлой волокнистой, заключенной в соединительнотканный футляр (рис. 2) [6, 7].
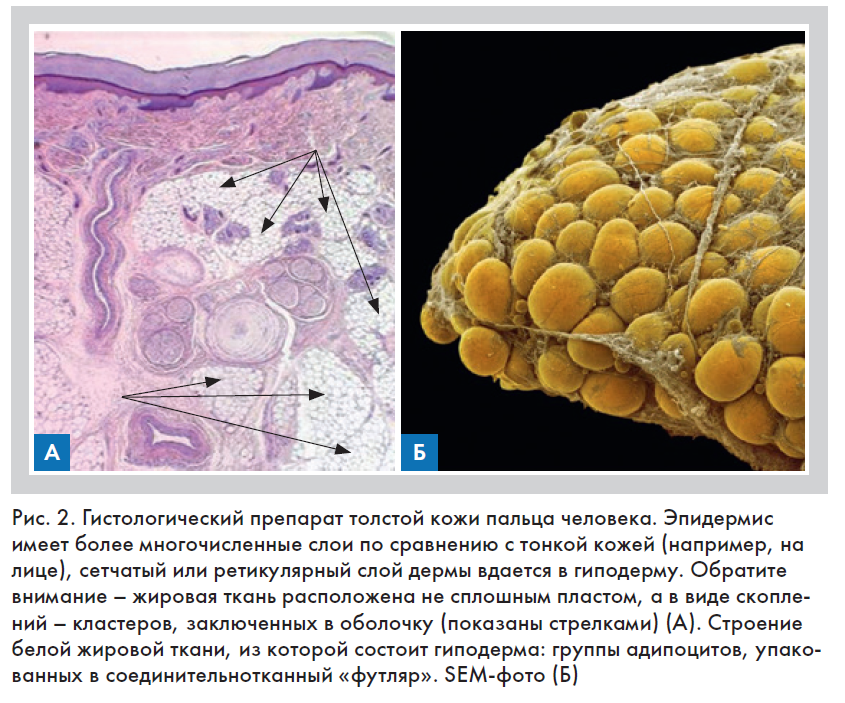
На лице распределение жировой ткани имеет свои уникальные особенности, так как оно, не защищенное одеждой, ранее других участков тела испытывает агрессивное воздействие внешней среды, и гиподерма в этой области тела выполняет, прежде всего, функцию теплоизоляции.
R. Rochrich и J. Pessa в 2007 г. описали поверхностные и глубокие жировые компартменты, или пакеты, в области лицевого отдела черепа, что имело большое значение для врачей эстетической медицины, объясняло механизмы возрастных изменений и помогло достигнуть большей эффективности при проведении нитевого лифтинга, вследствие чего появилась возможность работы как с изолированным жировым компартментом, так и с их группой [8]. Mac Gregor (1981), G. Psillakis (1984) и D. Furnas (1989) до открытия R. Rochrich и J. Pessa описали точки фиксации и некоторые удерживающие связки на лице, положение которых совпало с местами слияния данных компартментов [9], что оптимизировало процедуру тредлифтинга – описанные структуры стали использоваться как якорные зоны при имплантации нитей (рис. 3А). В 2018 г. S. Kotofana с коллегами опубликовали результаты исследования, где они с помощью МРТ и последующей диссекции установили линейные размеры и объем вышеупомянутых компартментов, что оптимизировало методику контурной инъекционной пластики (рис. 3 Б) [10].
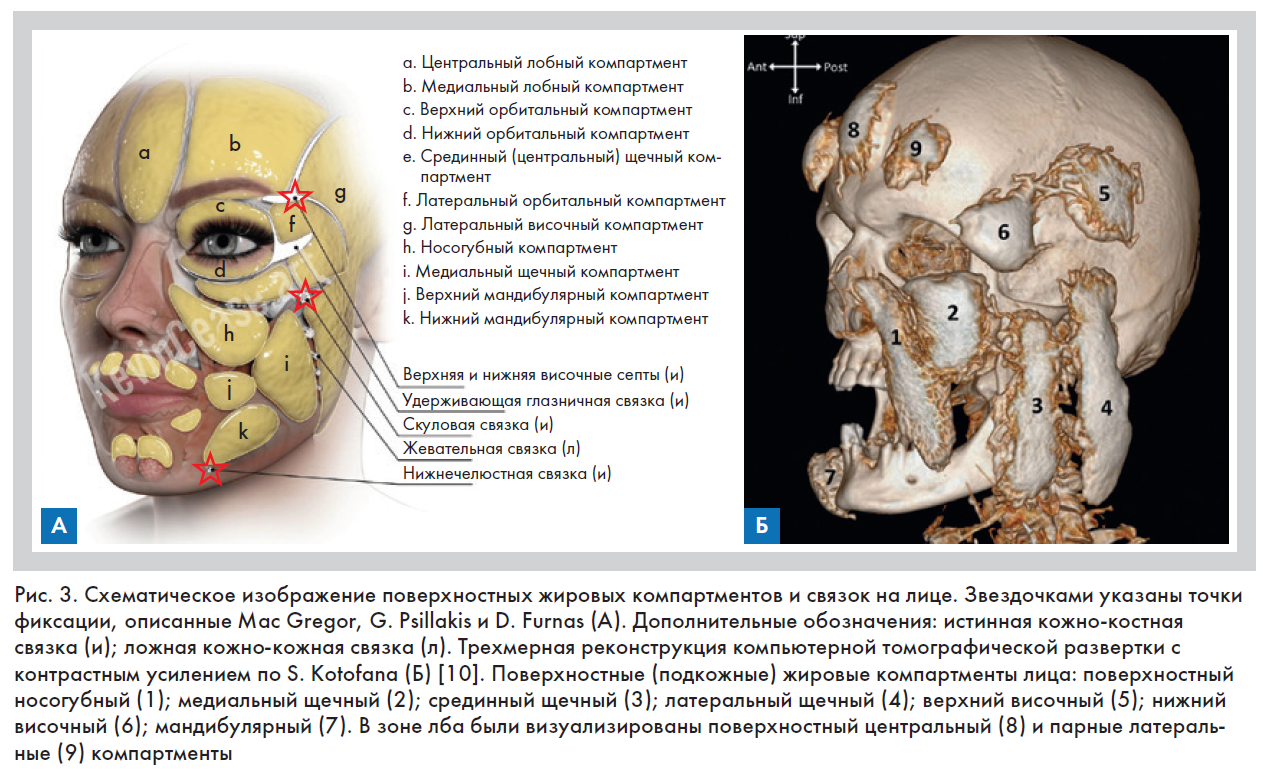
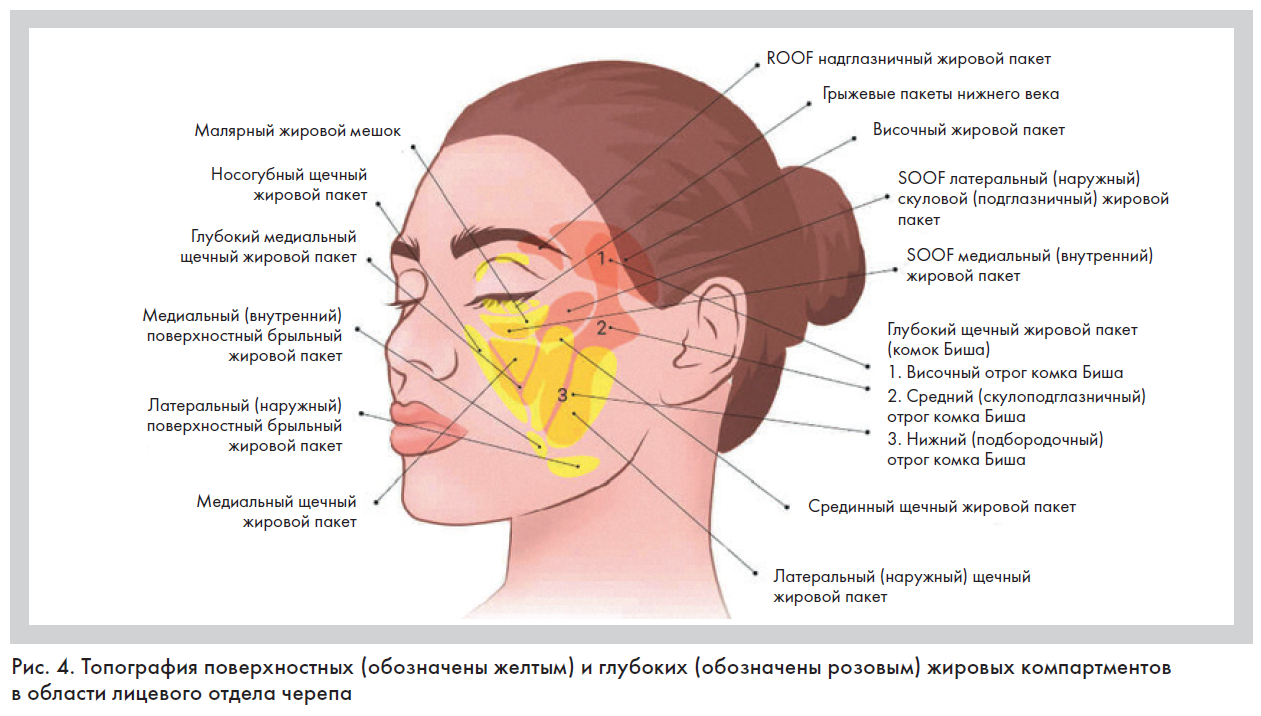
Позднее было установлено, что поверхностные (ПЖК) и глубокие (ГЖК) жировые компартменты имеют некоторые функциональные и морфологические отличия (рис. 4) [8–11]:
• по топографии: ПЖК располагаются над поверхностной мышечно-апоневротической системой (SMAS), а ГЖК – под ней;
• по эстетической значимости: ПЖК отвечают за плавные контуры лица, ГЖК – за объем;
• по инволюции: ГЖК более стабильны и хуже васкуляризируются, ПЖК склонны к атрофии и миграции;
• по гидрофильности: она выше у поверхностных компартментов по сравнению с глубокими;
• по размеру адипоцитов: они больше у поверхностных компартментов;
• по гендерному признаку: у женщин адипоциты крупнее.
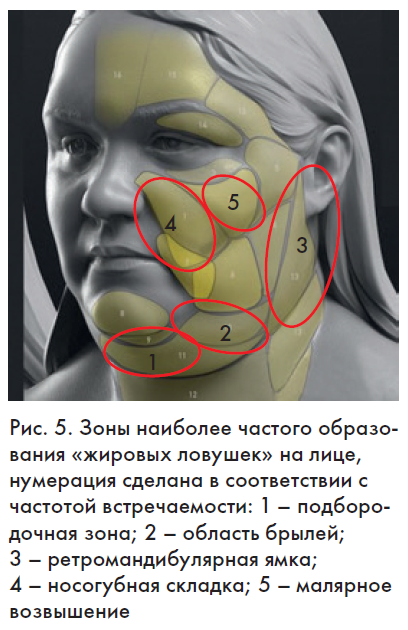
Помимо вышесказанного надо иметь в виду, что гиподерма в зоне лицевого отдела черепа склонна к образованию так называемых «жировых ловушек», которые представляют собой отложения подкожного жира с четкими границами. Чаще всего они наблюдаются в подбородочной области (у мужчин уже в 30 лет), на нижней челюсти в виде брылей, в зоне носогубной складки, ретромандибулярной ямки, скуловой области и на задней поверхности шеи (рис. 5). Причиной образования таких ловушек может стать локальная гипертрофия глубокого (субфасциального) жирового слоя и особая чувствительность адипоцитов к глюкозе, которая передается по наследству [6]. Эти образования практически не поддаются коррекции диетами, физической нагрузкой, аппаратными и медикаментозными методами, а только хирургическому иссечению.
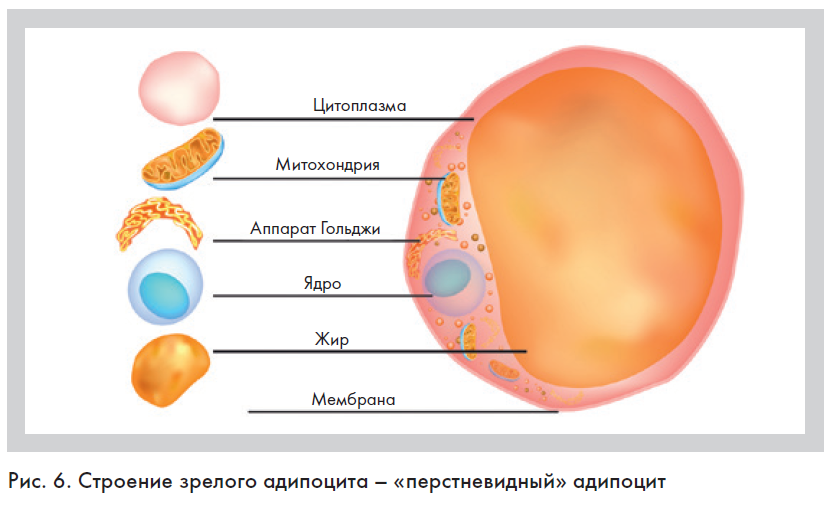
Жировая ткань, составляющая основу гиподермы, относится к соединительным тканям со специальными свойствами. Основной объем жировой ткани составляют ее «рабочие клетки» – адипоциты (от лат. adeps – жир и cytos – клетка) [7].
Исходя из специфики эстетической медицины, наиболее значимыми являются следующие функции гиподермы [7, 8, 11]:
• моделирующая, опорная и защитная – жировая ткань отвечает за объем и плавность очертания у молодых лиц, служит опорным и фиксирующим элементом для вышележащих слоев кожи и подлежащих мышц. Она окружает лимфатические узлы головы и шеи, сопровождает сосудисто-нервные пучки и защищает их от возможных механических травм;
• теплоизолирующая – жировая ткань обладает свойствами теплоизолятора, благодаря чему она препятствует чрезмерной потере тепла, что особенно важно для человека, лишенного шерсти;
• пластическая – после инволюции замещает ткань некоторых органов (например, молочной железы, лимфатических узлов);
• энергетическая (трофическая) – за счет липидов служит в организме резервным источником энергии (например, при анорексии или кахексии лицо практически лишается подкожной жировой клетчатки и приобретает характерный вид – facies phtisica);
• депонирующая и эндокринная – жировая ткань накапливает жирорастворимые витамины (А, D, Е, К) и служит депо стероидных гормонов. В ней синтезируются эстрогены и гормон, регулирующий потребление пищи, – лептин. Способность жировой ткани продуцировать эстрогены не всегда оказывается полезной. Установлено, что жировая ткань, окружающая опухоль молочной железы, оказывает стимулирующее влияние на ее рост [7].
Жировая ткань развивается из мезенхимы. Предшественником ее рабочих клеток – адипоцитов служат малодифференцированные фибробласты, лежащие по ходу мелких кровеносных сосудов [7]. Это значит, что нити, активизирующие образование новых сосудов (например, из полидиоксанона), в большей степени будут стимулировать пролиферативную активность фибробластов в отношении неоколлагеногенеза [3]. В ходе дифференцировки в цитоплазме преадипоцита (после появления ферментов, ответственных за синтез липидов) начинают накапливаться мелкие липидные капли, далее они сливаются в одну крупную, которая смещает цитоплазму и ядро к периферии. Зрелый адипоцит приобретает сферическую форму и в световом микроскопе напоминает фигуру «перстня» (рис. 6). При голодании, сопровождающемся усилением процессов липолиза, возможны обратные морфологические преобразования адипоцита, при которых большая жировая капля дробится на мелкие с последующим их исчезновением, и адипоцит превращается в фибробластоподобную клетку [7].
Влияние гормонов на кожу и жировую ткань
При отборе пациентов для проведения нитевого лифтинга, особенно с заболеваниями эндокринной системы, надо помнить, что жировая ткань является главной тканью-мишенью инсулина, который отвечает за процессы разрушения и накопления адипоцитов. При сахарном диабете отмечаются не только повышение уровня глюкозы, но и неэстерифицированных жирных кислот и липопротеинов, при этом главным источником энергии у таких больных становятся не углеводы, а жиры [7].
Помимо этого, установлено, что адипоциты имеют рецепторы к половым гормонам, что необходимо учитывать при проведении косметологических процедур, особенно у женщин. С одной стороны, под воздействием эстрогенов у женщин происходит обновление клеток эпителия, а в дерме увеличивается производство гиалуроновой кислоты, обеспечивающей эластичность и гладкость кожи [7]. С другой стороны, начиная с момента полового созревания под действием эстрогенов происходит активизация элементов соединительной ткани, из которой состоят связки и фасции на лице, а также фиброзный компонент подкожной жировой клетчатки [12]. В результате с возрастом связки уплотняются и становятся короче, фасции утолщаются и твердеют, а септы между жировыми компартментами контурируются, что является одной из причин исчезновения плавных контуров лица, приводит к углублению носогубных складок, формированию брылей, малярных мешков и появлению целлюлита на теле. Больше всего рецепторов к эстрогену на женском лице обнаружено в области губ [13]. Например, у беременных наблюдается гипертрофия губ (особенно если плод девочка), а у возрастных пациенток развиваются кисетные морщины в результате уплотнения и визуализации септ, отделяющих жировые компартменты в данной зоне лица.
Мужской половой гормон – тестостерон по своей химической структуре является анаболиком. Под воздействием тестостерона, так же как и у женщин, происходит активизация клеток соединительной ткани, ответственных за выработку коллагена и эластина, что делает кожу мужчин более толстой и плотной, тем самым увеличивая степень ее гидратации и тургора, поэтому морщины у мужчин появляются позднее по сравнению с их сверстницами женского пола [14].
Иммунная система кожи
Установлено, что помимо лимфоцитов в коже содержится большое количество дендритных клеток, фагоцитов и гуморальных факторов врожденного иммунитета, поэтому кожу считают отдельным периферическим иммунным органом, который встречается в специализированной литературе под именем SIS (skin immune system) [15]. Особенностью кожи как иммунного органа является преобладание врожденного иммунитета над адаптивным. В то же время в системе врожденного иммунитета кожи значительно превалируют клеточные факторы, к которым относят дендритные клетки, макрофаги, Т-лимфоциты-γ/δ, тучные клетки и естественные киллеры. При необходимости в кожу могут мигрировать нейтрофилы и эозинофилы (рис. 7) [16].
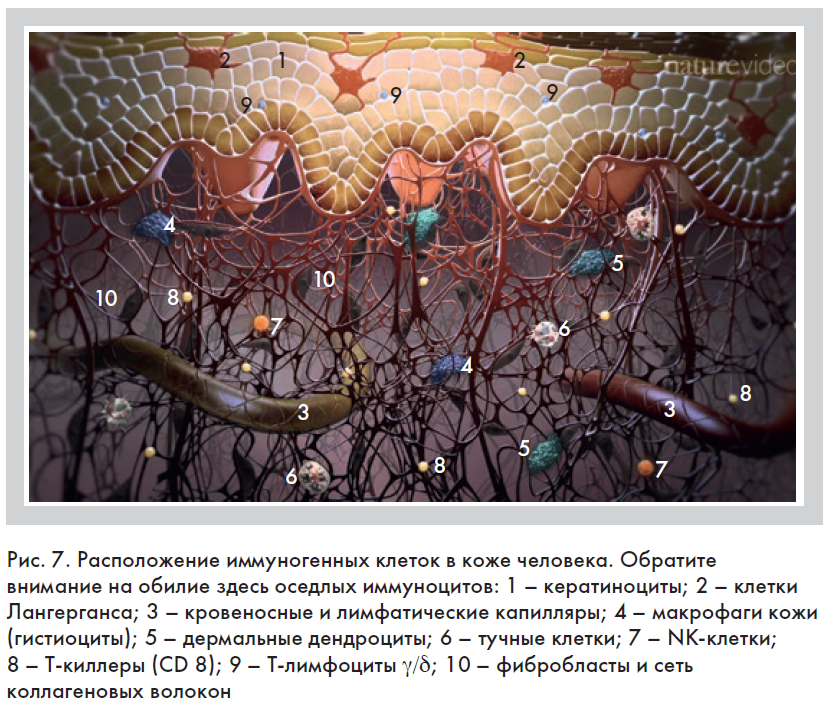
В нашей коже содержатся три разновидности клеток макрофагального происхождения, которые помимо фагоцитоза исполняют функции антигенпрезентирующих клеток, синтезируют каскад цитокинов и регулируют процессы регенерации тканей (рис. 7) [7, 16, 17]:
1) клетки Лангерганса, или внутриэпидермальные дендритные клетки, – распределены по базальному и шиповатому слоям эпидермиса;
2) дермальные дендроциты располагаются в дерме и гиподерме. Они обеспечивают иммунологическую толерантность к собственным антигенам кожи, которые высвобождаются при травмах и воспалении. При повреждении кожи мигрируют в регионарные лимфатические узлы, где активизируют пролиферацию лимфоцитов;
3) макрофаги кожи (они же гистиоциты) – осуществляют фагоцитоз и презентацию антигена, могут разрушать крупные патогены (инородное тело или внутрикожного гельминта), удаляют тканевый дендрит из зоны повреждения, продуцируют ростовые факторы, способствуя заживлению ран. Гистиоциты – связующее звено между воспалением и регенерацией.
Т-лимфоциты γ/δ – уникальная популяция оседлых тимуснезависимых лимфоцитов, которые еще внутриутробно тремя волнами заселяют сначала кожные покровы, а затем слизистые оболочки пищеварительной и мочеполовой систем. Данная разновидность лимфоцитов выполняет терминирующую функцию при иммунном ответе и контролирует процессы регенерации, продуцируя ростовые факторы [7, 17].
Естественные киллеры кожи, или натуральные киллеры (NK), относят к особой оседлой популяции лимфоцитов. Уничтожают инфицированные, опухолевые, мутировавшие, старые, поврежденные, чрезмерно пролиферирующие клетки, придают коже здоровый, моложавый вид [7, 17].
Тучные клетки, тканевые базофилы, или лаброциты, располагаются вблизи гемокапилляров, лимфатических сосудов и нервов. Тучные клетки вызывают мощную экссудативную реакцию в ответ на широкий спектр антигенов. Высвобождение гистамина и других вазоактивных медиаторов повышает проницаемость сосудов и ускоряет местный кровоток. Механизм индукции воспаления тучных клеток связан с экзоцитозом и высвобождением гистамина, гепарина, агрессивных ферментов и эозинофильного хемотаксического фактора, а также секрецией простагландинов, лейкотриенов и целого ряда провоспалительных цитокинов, способствующих разворачиванию иммунной реакции [7]. Установлено, что тучные клетки могут выбрасывать секрет гранул в ответ на боль [17].
Нейтрофилы – коротко живущие клетки (6–7 часов в циркулирующей крови и несколько дней присутствуют в соединительных тканях). Первичные (азурофильные) гранулы нейтрофилов содержат миелопероксидазы, кислую фосфатазу, эластазу и др. Вторичные – щелочную фосфатазу, лактоферрин и коллагеназу. Лизоцим присутствует в обоих типах гранул. Нейтрофилы могут фагоцитировать микробы и мелкие частицы, способны формировать реактивные виды кислорода, включая супероксид, радикалы и перекись водорода [7, 16,17].
Эозинофилы – коротко живущие клетки (10 часов в циркулирующей крови и несколько дней в тканях). Гранулы содержат лизосомальные ферменты – кислую фосфатазу, рибонуклеин, фосфолипазу и миелопероксидазу. Фермент гистоминаза из гранул эозинофилов ограничивает воспалительные последствия дегрануляции тучных клеток, а коллагеназа приводит к разрушению тканей, что наблюдается при контактных дерматитах и экземе. Эозинофилия в крови может говорить
о таких изменениях патологического характера, как глистная инвазия, аллергическая реакция, а также наблюдается в фазу выздоровления от инфекционно-воспалительных заболеваний, что получило название «эозинофильная заря
выздоровления», очевидно, за розовую окраску данных клеток в световом микроскопе [7, 16, 17].
Лимфоциты – клетки адаптивного иммунитета. Большинство имеющихся в коже лимфоцитов представлено Т-клетками, относящимися к клеточному звену иммунной системы, 90% таких клеток располагаются вокруг посткапиллярных венул или придатков кожи – местах вероятного проникновения антигена. Цитотоксические лимфоциты – Т-киллеры, залегающие в дерме и гиподерме, составляют около 40% общего пула кожных иммуноцитов. Они выполняют работу по уничтожению скомпрометированных клеток и поддержанию антигенного гомеостаза кожных покровов. Количество регуляторных Т-супрессоров, которые угнетают иммунный ответ, составляет менее 5%, что соответствует современным представлениям о коже как об эффекторном органе иммунитета. Даже в относительно спокойной обстановке большинство кожных Т-лимфоцитов пребывает в активированном состоянии, что доказывается высокой экспрессией молекул HLA-DR и рецепторов к интерлейкину-2. Это значит, что иммунные клетки кожи находятся в постоянной готовности к осуществлению специфического ответа на патоген [18].
Современные представления о патогенезе дермального фиброза
В последние десятилетия в исследовании дермального фиброза особое внимание уделяется роли механического (тензионного) давления на фибробласты как определяющего фактора, регулирующего их активность [20]. В течение 4–5 дней с момента травмы (в нашем случае введения нити) фибробласты трансформируются в особую разновидность – миофибробласты [19]. При этом цитоскелет фибробластов перестраивается: главный белок β-актин заменяется на его более удлиненную версию – a-SMA. За счет появления у миофибробластов сократительных белков они стягивают ткани вокруг области повреждения (для уменьшения площади травмы) и начинают синтезировать временный матрикс из коллагеновых фибрилл, необходимый как структурный каркас для последующего заполнения его «правильными» клетками [21]. После выполнения вышеуказанных задач миофибробласты погибают по механизму апоптоза, и на смену им приходят обычные фибробласты, которые и завершают процесс репарации (при небольших дефектах – за 3–4 недели). Если элиминация фактора, вызвавшего воспаление, не произошла, он продолжает поддерживать производство провоспалительных цитокинов, при котором удаления миофибробластов не происходит, и они продолжают активно вырабатывать коллаген, фибронектин и гиалуроновую кислоту [22]. При этом гистологический анализ показывает наличие коллагена с образованием вследствие внутренних сшивок гораздо более жестких фибрилл, что при установке армирующих нитей и обеспечивает их основное косметологическое воздействие. Выяснили, что механо-эластические свойства такой фиброзной структуры на 80% превышают аналогичные свойства у нормальной кожи. Примерно через месяц в области имплантации наблюдается увеличение коллагена I и III типов. Если нить установлена с соблюдением правил асептики, такой индуцированный неоколлагеногенез не сопровождается воспалением и не вызывает неконтролируемого фиброза [19].
Реакция иммунной системы кожи при тредлифтинге
С точки зрения иммунологии, в ответ на введение нити развивается воспаление. По определению ведущего российского патолога Струкова А.И. (2010), воспаление – комплексная местная сосудисто-мезенхимальная реакция на повреждение ткани, вызванная действием различного рода агентов [23]. Воспаление – местное проявление общей реакции, в которой участвуют нервная, эндокринная и иммунная системы, что необходимо учитывать при отборе пациентов для проведения тредлифтинга. Клетки, осуществляющие воспалительную реакцию, являются участниками неспецифической (врожденной) и специфической (адаптивной) иммунной защиты, а цитокины, выделяемые ими, считаются общими сигнальными молекулами для трех вышеупомянутых регуляторных систем [7, 15, 23].
От момента имплантации и до третьих суток воспаление протекает как острое и характеризуется преимущественным накоплением нейтрофильных гранулоцитов и белкового экссудата в зоне имплантации [7, 23]. Так как устранения повреждающего агента не произошло (установленная нить остается в ткани), острое воспаление сменяется хроническим. При этом происходит инфильтрация ткани макрофагами и лимфоцитами, пролиферация фибробластов и рост мелких кровеносных сосудов, то есть начинается регенерация поврежденной ткани [7, 15, 23].
Любой воспалительный процесс проходит три последовательные стадии: фазу альтерации (повреждения), экссудации и пролиферации, которые могут частично перекрываться [7, 23].
Смена данных фаз связана с действием медиаторов воспаления, которые в зависимости от источника подразделяются на клеточные и тканевые. Первые синтезируются эффекторными клетками иммунной системы – тромбоцитами, лейкоцитами, макрофагами, тучными клетками и лимфоцитами.
Медиаторы клеточного происхождения вызывают повышение проницаемости стенки сосудов и активацию фагоцитоза, обладают бактерицидным действием, вызывают вторичную альтерацию (гистолиз), регулируют пролиферацию и дифференцировку клеток в очаге воспаления, направленные на репарацию ткани.
Тканевые медиаторы воспаления синтезируются в печени или почках и с током крови доставляются в зону воспаления. К ним относят каликриин-кининовую систему, свертывающую систему крови, систему комплемента [23].
Смена одних медиаторов другими обусловливает смену клеток в очаге воспаления – от полиморфно-ядерных лейкоцитов и фибробластов до макрофагов, призванных для репарации тканей.
Патогенез и этапы воспалительного процесса при имплантации нити
Фаза альтерации (от лат. alieratio – изменение, нарушение) начинается с повреждения ткани и инициирует начало воспаления. Прокол и введение нити сопровождаются нарушением структуры клеток, тканей, а также субклеточных структур, приводящим к изменению их метаболизма. Разделяют первичную альтерацию – зону повреждения, соответствующую области прокола кожи, и вторичную – вызванную воздействием медиаторов воспаления, на которую флокогенный фактор, инициирующий воспаление, практически не влияет (например, повреждение клеток в демаркационной зоне вокруг введенной нити) [7, 23].
Фаза экссудации (от лат. exudatio – выпотевание) – проникновение элементов крови (плазмы и форменных элементов) через стенку кровеносного сосуда в ткань с образованием экссудата [7, 23]. В своем развитии проходит несколько этапов:
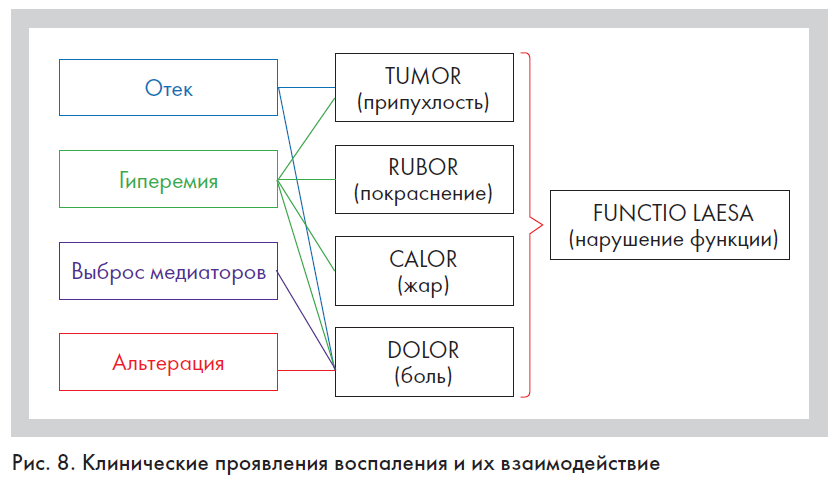
→ Реакция микроциркуляторного русла начинается с кратковременного (длительностью от нескольких секунд до нескольких минут) спазма мелких артерий и артериол, который сменяется их расширением. Возникает артериальная, а затем и венозная гиперемия, которая может продолжаться от нескольких часов до нескольких суток и сопровождается типичными местными признаками воспаления – покраснением ткани (rubor) и повышением ее температуры (calor) (рис. 8). Механизм гиперемии связан с выделением вазоактивных веществ – гистамина, кининов, серотонина и др., относящихся к клеточным медиаторам воспаления.
→ Экссудация составных частей плазмы крови сопровождается выходом за пределы сосуда жидких составных частей крови: воды, белков и электролитов. Накопление экссудата в тканях ведет к увеличению ее объема – образованию отека (tumor), сдавлению нервных окончаний и появлению боли (dolor), что является следствием выделения медиаторов боли (кининов) и повышения гидростатического давления в области очага воспаления и в итоге обусловливает нарушение функции органа (functio laesa) (рис. 8). Экссудация способствует притоку в очаг альтерации бактерицидных факторов сыворотки (антител, компонентов комплемента), фибриногена и т. д.
→ Изменения реологических свойств крови и выход форменных элементов в ткани. По мере замедления кровотока активируются адгезивные взаимодействия лейкоцитов с эндотелиальными клетками (преимущественно посткапиллярных венул) и выход их за пределы сосуда. Далее под действием хемоатрактантов они перемещаются по межклеточному веществу в зону повреждения. Экспериментально установлено, что нейтрофилы прибывают в очаг воспаления примерно через 10 минут после альтерации, а через 4–6 часов их содержание здесь достигает максимума (составляя ≈ 90% от всех клеток). Нейтрофильные гранулоциты в очаге воспаления выполняют фагоцитарную функцию, которая реализуется через продукты «респираторного взрыва» и лизосомальные ферменты. Они вызывают дальнейшую деструкцию клеток, сосудов и элементов соединительной ткани. Продукты их распада вызывают приток новых нейтрофилов, а позднее – через 16–24 часов – моноцитов и макрофагов. Содержание последних в очаге воспаления достигает максимума на третьи сутки. Макрофаги сначала концентрируются по периферии зоны повреждения, а затем проникают вглубь нее. Они фагоцитируют погибшие нейтрофилы, клеточный детрит и микроорганизмы, формируя второй отграничивающий (антимикробный) барьер. Одновременно с ними или несколько позднее сюда эмигрируют лимфоциты [7].
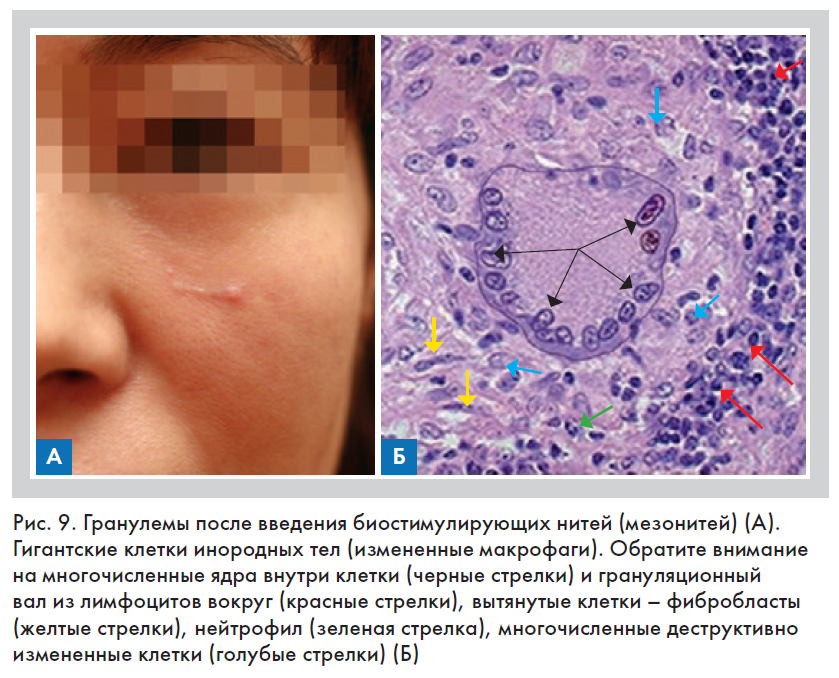
По мнению ряда авторов, после введения нити воспаление изначально может развиваться как хроническое и асептическое, при этом в зоне повреждения численно преобладают макрофаги и лимфоциты [20]. Макрофаги в очаге хронического воспаления способны преобразовываться – сливаясь друг с другом, они формируют гигантские многоядерные клетки, так называемые «гигантские клетки инородных тел», которые являются частой находкой при формировании гранулем
(рис. 9Б) [24].
Причины возможных осложнений нитевого лифтинга
Гранулемы инородных тел как осложнение после нитевого лифтинга формируются в течение шести – двадцати четырех месяцев после имплантации нити. Как правило, они локализуются в местах проколов и похожи на небольшие бляшки или папулы, цвет которых отличается или нет от цвета остальной кожи (рис. 9А). Такие гранулемы могли изъязвляться, нагнаиваться, расти с образованием псевдоопухоли, некротизироваться или самопроизвольно исчезать [16, 24]. В отличие от наблюдаемого практически в 100% случаев факта инкапсуляции нити гранулема очень часто сопровождается хронической воспалительной реакцией [24]. Клиническая практика показала, что среди возможных причин развития
гранулемы после тредлифтинга можно рассматривать введение новых нитей поверх уже имеющихся при несоблюдении рекомендованного интервала между процедурами, или если в тканях пациента находились ранее введенные филлеры [24]. Показанием для хирургического удаления гранулемы являются наличие вторичной инфекции, подтвержденной микробиологическими методами, признаки интоксикации, близкое ее расположение к крупным сосудам и нервам, постоянный болевой синдром, выраженная реакция гиперчувствительности, эстетический дефект и другие. Диагноз гранулемы, возникшей в результате реакции на введение нити, ставится на основании клинической картины и анамнеза. Наиболее
распространенными методами диагностики гранулем являются УЗИ, рентгенография, компьютерная томография, но самым точным остается гистологическое исследование [16, 24].
Асептическое воспаление – это воспаление при воздействии факторов механической, физической или химической природы, но без участия микробов [23]. Развитие асептического воспаления в практике врача эстетической медицины чаще всего происходило при закрытых механических или химических повреждениях, к которым можно отнести введение нитей и филлеров, аллергическую реакцию на их компоненты, а также использование лазеров, пилингов и других инвазивных косметологических методик, включая ультрафиолетовое облучение (рис. 10).
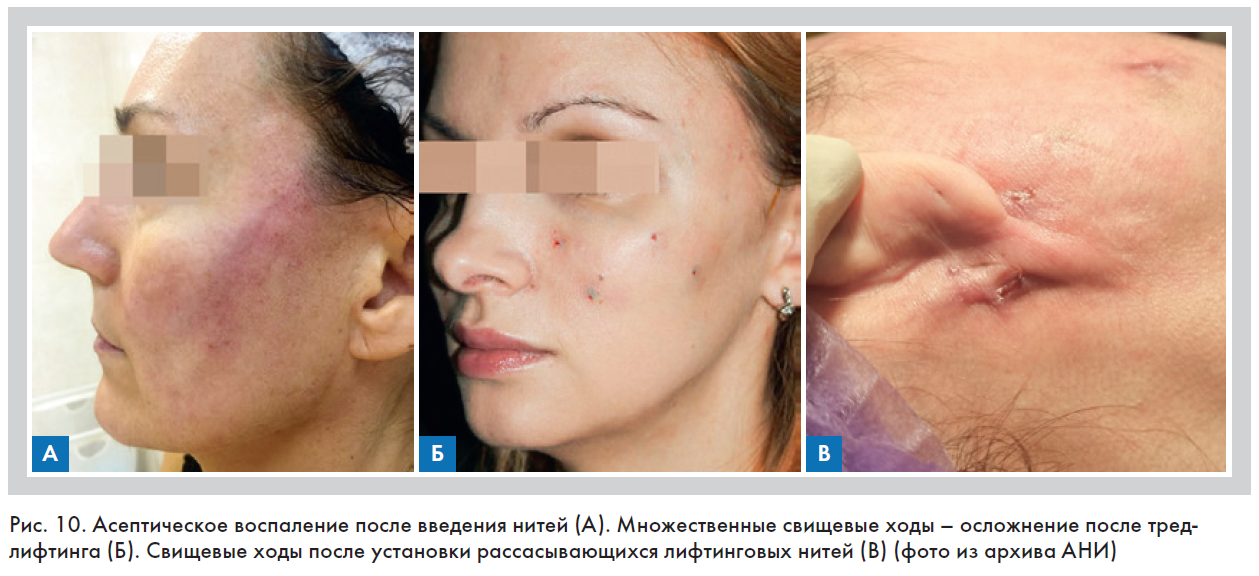
Отличительной особенностью асептического воспаления, возникшего как осложнение после нитевого лифтинга, является проявление только местных (за исключением аллергических) клинико-морфологических изменений, которые ограничены зоной имплантации. Оно может быть двухсторонним или односторонним и обычно сопровождается локальным покраснением и уплотнением тканей над зоной прокола (рис. 10А). Если присоединяется вторичная инфекция, то асептическое воспаление превращается в септическое, которое может привести к формированию абсцессов или свищевых ходов (рис.10 Б, В). Общая реакция организма при асептическом воспалении, проявляющаяся повышением температуры тела, учащением пульса, дыхания и нейтрофильным лейкоцитозом, в продемонстрированном конкретном случае отсутствовала. Однако при выраженной экссудативной реакции могла появиться непродолжительная по времени (до 24 ч) асептическая резорбтивная лихорадка, характеризующаяся повышением температуры тела на 0,5–1°С, но без учащения пульса и нейтрофильного лейкоцитоза. При воспалении аллергической природы кроме местных клинических признаков наблюдались общие изменения состояния организма в виде повышения температуры тела и учащения пульса, однако при этом нейтрофильный лейкоцитоз также отсутствовал [16, 23].
Клинический опыт показал, что в зону риска в плане развития асептического воспаления как осложнения после нитевого лифтинга попадали пациенты с иммунодефицитными состояниями – в первую очередь лица пожилого возраста, имеющие хронические или аутоиммунные заболевания, очаги инфекции в зубочелюстной системе и ЛОР-органах, с нарушением противоопухолевого иммунитета, в анамнезе у которых были выявлены доброкачественные и тем более злокачественные новообразования, а также пациенты, у которых после выздоровления от COVID-19 не прошло двух месяцев.
Фаза пролиферации
Фаза пролиферации (от лат. proles – потомство, fero – несу). Макрофаги, лимфоциты и другие клетки, инфильтрирующие очаг воспаления, выделяют ряд биологически активных веществ (фибронектин, ИЛ-1, фактор некроза опухоли, фактор роста фибробластов, фактор роста сосудов и др.), которые вызывают хемотаксис, пролиферацию и стимуляцию синтетической активности фибробластов, а также активацию образования и роста сосудов (ангиогенез). В результате привлечения в очаг воспаления фибробластов, их усиленной пролиферации и активной синтетической деятельности, а также быстрого разрастания мелких сосудов вокруг имплантата формируется рыхлая молодая, богато васкуляризованная грануляционная ткань. Со временем грануляционная ткань «созревает». При этом в ней уменьшается количество кровеносных сосудов, нервные окончания атрофируются, а количество коллагеновых волокон постепенно увеличивается, и она
превращается в плотную волокнистую ткань, которая формирует рубец (создает армирующий эффект при введении соответствующего типа нитей) или образует капсулу вокруг имплантата, наличие которой фиксировалось почти в 100% клинических наблюдений, как мы указывали выше [7, 17, 19, 20, 21, 23].
Нарушение баланса между образованием и разрушением коллагена может приводить к избыточному отложению коллагеновых волокон (диффузному или очаговому), которое характерно для фиброза (о чем мы писали выше) [20]. Для исключения избыточного отложения коллагена и предотвращения неконтролируемого фиброза нити покрывают особыми веществами. Например, экспериментально установлено, что цинк участвует в регулировании фиброзообразования за счет подавления активируемого гипоксией фактора HIF-1a, который вносит основной вклад в превращение фиброза в неконтролируемый процесс [25]. Цинк и кремний оказывают стимулирующее воздействие на содержание коллагена
III типа, а наночастицы золота в разы увеличивают выработку металлопротеаз, которые разрушают избыточный фиброзный матрикс [26].
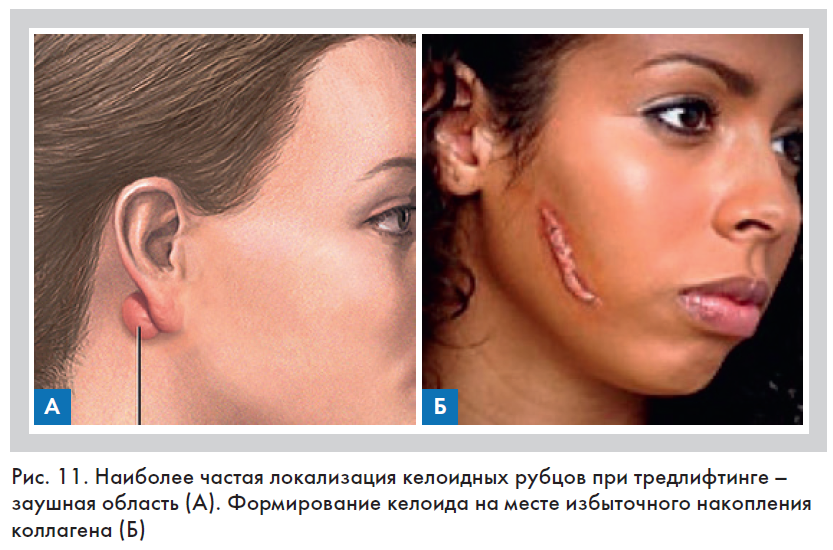
Неконтролируемый фиброз может привести к образованию втяжений на коже и ее смещению, появлению деформирующих рубцов, а также нарушить иннервацию и трофику мягких тканей лица. Избыточное накопление коллагена в участках повреждения кожи может привести к формированию утолщенных келоидных рубцов (от греч. kele – опухоль и oidos – подобный) (рис. 11) [23].
В стадию пролиферации, или продуктивную фазу воспаления, помимо формирования вокруг нити «протекторного следа» происходит активный синтез коллагена, эластина и межуточного вещества соединительной ткани, которые обеспечивают [7]:
• повышение механических свойств кожи – прочности, упругости и эластичности;
• улучшение архитектоники кожи – сглаживается ее рельеф, расправляются морщины и складки, подтягивается овал лица. Важно помнить, что для синтеза коллагена необходим витамин С (аскорбиновая кислота). Поэтому его целесообразно назначать пациентам в период реабилитации и для усиления эффекта от тредлифтинга [7];
• активный синтез основного аморфного вещества соединительной ткани включает производство протеогликанов и гликопротеинов, тем самым увеличивается содержание в зоне имплантации гиалуроновой кислоты, дерматансульфата, гепарансульфата и гепарина, которые:
– влияют на образование коллагеновых волокон (способствуют правильной укладке фибрилл в волокнах и ограничивают их рост в толщину);
– обеспечивают связи между поверхностью клеток и компонентами межклеточного вещества (фибронектином, ламинином и коллагеном);
– играют важную роль в транспорте электролитов и воды, то есть увеличивают гидратацию кожи;
– связывают, накапливают и выделяют факторы роста (особенно активно эту функцию осуществляют гепарин и гепарансульфат);
– активизируют обновление клеток всех слоев кожи и улучшают ее трофику.
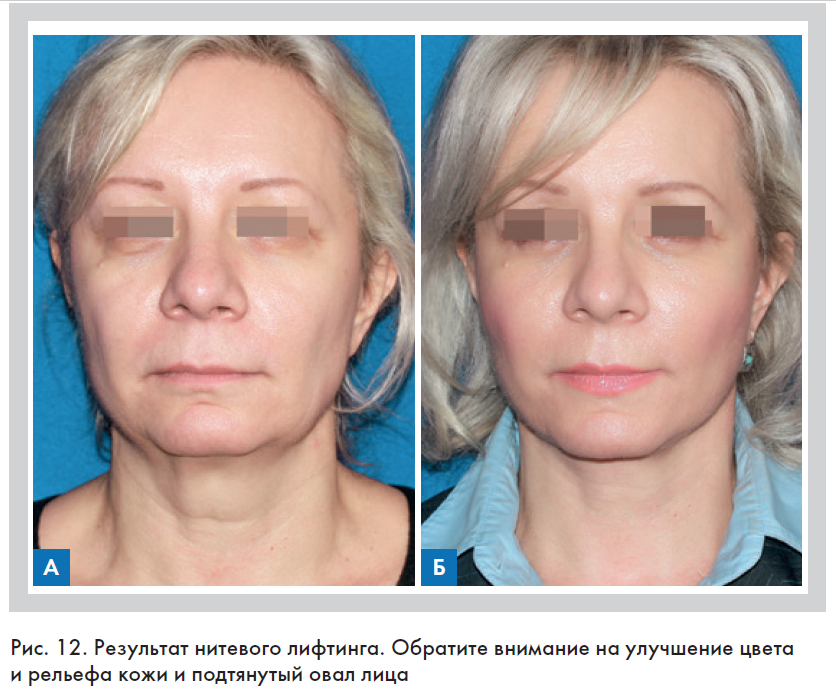
Поэтому результатом тредлифтинга можно назвать качественное омоложение кожи (рис. 12) [27, 28].
И в заключение
Нитевой лифтинг на сегодняшний день очень популярная косметологическая процедура, эффект от которой продолжается от 1,5 до 5 лет и имеет кумулятивный характер. Последний достигается за счет перемещения тканей при имплантации нитей, а далее нарастает в процессе физиологической репарации тканей за счет активации фибробластов, которые, во-первых, синтезируют коллагеновые волокна (инкапсулируют инородное тело и тем самым усиливают армирующий эффект процедуры), а во-вторых, синтезируют межуточное вещество соединительной ткани (в том числе гиалуроновую кислоту, которая повышает гидратацию тканей). Помимо этого, в процессе репарации тканей активизируется образование новых сосудов, что ведет к улучшению трофики тканей в зоне имплантации.
Для достижения оптимального результата тредлифтинга необходимо знание иммунологических процессов, протекающих в кожных покровах после введения нити, что поможет врачам-имплантологам в отборе пациентов для процедуры, а также избежать нежелательных явлений при его проведении.
Литература
[1] Груздев Д.А. Классификация и маркировка нитевых изделий // Метаморфозы. – 2021. – № 35. – С. 44–50.
[2] Анатомическое обоснование нитевых подтяжек верхней трети лица / С.В. Прокудин, И. Сабан, Н.Е. Мантурова, О.Р. Газиулина // Вестник эстетич. медицины. – 2013. – № 3. – С. 20–28.
[3] Крюкова С.В., Мезенцев Ю.А., Мухина Т.В. Гистологические особенности биодеградации нитей, используемых в косметологии // Метаморфозы. – 2021. – № 35. – С. 14–25.
[4] Анатомия нитевых подтяжек субментальной зоны и шеи / С.В. Прокудин, И. Сабан, Н.Е. Мантурова, О.Р. Газиулина // Вестник эстетической медицины. – 2014. – № 1. – С. 40–46.
[5] Зорина А.И., Бозо И.Я., Зорин Б.Л. Фибробласты дермы: особенности цитогеннеза, цитофизиологии и возможности их клинического применения // Клеточная трансплантология и тканевая инженерия. – 2011. – № 6 (2). – С. 15–26.
[6] Stuzin J.M., Baker T.J., Gordon H.L. The relationship of the superficial and deep facial fascias. Relevance to rhytidectomy and aging // Plast.Reconstr. Surg. – 1992. – V. 89 (3). – P. 441–449.
[7] Быков В.Л. Частная гистология человека (Краткий обзорный курс): учебник. – СПб.: Сотис, 2002. – 304 с.
[8] Rochrich R.J., Pessa J.E. The fat compartments of the face: anatomy and clinical implications for cosmetic surgery // Plast. Reconstr. Surg. – 2007. – V. 119. – P. 2219–2227.
[9] Rochrich R.J., Pessa J.E. The rationing system of the face: Histologic evaluation of the septal boundaries of the subcutaneous fat compartments // Plast. Reconstr. Surg. – 2008. – V. 121. – P. 1804–1809.
[10] Kotofana S. et all. Functional anatomy of the superficial fatty parts of the face: a detailed study of images. Plastic and Reconstructive Surgery: June 2018 – Volume 141 – Issue 6. – Pp. 1351–1359.
[11] Gierloff M., Stöhring C., Buder T., Wiltfang J. The subcutaneous fat compartments in relation to aesthetically important facial folds and rhytides. J Plast Reconstr Aesthet Surg. 2012; 65: 1292–1297.
[12] Wong C., Mendelson B. Anatomy of the aging face. In: Neligan P.C., ed. Plastic Surgery. Vol. 2. 3rd ed. Philadelphia, PA: Elsevier, Saunders; 2013: 78–92.
[13] Куприянов В.В., Стовичек Г.В. Лицо человека: анатомия, мимика. – М.: Медицина, 1988. – 272 с.
[14] Этинген Л.Е. Чем мужчина отличается от женщины: Очерки сравнительной анатомии. – М.: АСТ-ПРЕСС КНИГА, 2012. – 368 с.
[15] Рабсон А., Ройт А., Делвз П. Основы медицинской иммунологии. – М.: Мир. – 2006–320 с.
[16] Дерматовенерология. Национальное руководство. Краткое издание / под ред. Ю.С. Бутова, Ю.К. Скрипкина, О.Л. Иванова. – М.: ГЭОТАР-Медиа, 2013. – 896 с.
[17] Кожа человека (анатомия, гистология, гистопатология): учебное пособие для студентов медицинских вузов / П.А. Гелашвили, А.А. Супильников, В.А. Плохова. – Самара: РЕАВИЗ, 2013. – 168 с.
[18] Кашутин С.А. Лиганд-рецепторные механизмы пролиферативной активности иммунокомпетентных клеток у больных псориазом: автореф. дис… д-р мед. наук. – СПб, 2010.
[19] Хабаров В.Н. Коллаген в косметической дерматологии. – М.: ГОЭТАР – Мед, 2018. – 218 с.
[20] Carver W., Goldsmith E. Regulation of tissue fibrosis by the biomechanical environment. Biomed Res Int, 2013: 101979.
[21] Wells A., Nushke A., Yates C. Skin tissue repair. Matrix microenvironmental influences. Matrix Biol. 2016; 49: 25–36.
[22] Kim P., Chu N., Davis J. et all. Mechanoregulation of Myofiboblast Fate and Cardiac Fibrosis. Adu Biosyst. 2018; 2 (1): 1700172.
[23] Струков А.И., Серов В.В. Патологическая анатомия: учебник. – 5-е изд. – М.: Литера, 2010. – 880 с.
[24] Friedmann D.P., Kurian A., Fitzpatrick R.E. Delayed granulomatous reactions to facial cosmetic injections of polymethylmethacrylate microspheres and liquid injectable silicone: A case series. J Cosmet Laser Ther. 2016 Jun; 18(3): 170–173.
[25] Escobedo M., Barrado E., Alonso V., et all. Zinc Nutritional Status in Patients with Cystic Fibrosis. Nutrients, 2019: 11(1): 150.
[26] Хабаров В.Н., Бойков П.Я. и др. Перепрограммирование генома в адаптивных реакциях клетки. Влияние гиалуронанового гидрогеля с наночастицами золота на дифференцировку мезенхимных стволовых клеток в фибробласты // Молекулярная медицина. – 2019. – № 17 (1). – С. 32–36.
[27] Груздев Д.А., Овчинникова Д.В., Кодяков А.А. Комплексное омоложение кожи лица с использованием нитевых методов // Метаморфозы. – 2016. – № 13. – С. 36–41.
[28] Суламанидзе М.А., Суламанидзе Г.М. Метод нитевой подтяжки Aptos для омоложения лица и шеи: 10 лет использования // Les Nouvelles Esthetiques. – 2013. – № 4. – С. 50–65.
