Карпова Елена Ивановна - д.м.н., профессор кафедры кожных болезней и косметологии РНИМУ им. Н.И. Пирогова, член ОПРЭХ, Клиника Данищука, Москва
Данищук Ольга Игоревна - ассистент кафедры хирургии ФГБОУ ДПО ИПК ФМБА России, пластический хирург, дерматолог, Клиника Данищука, Москва
Иванова Елена Александровна - к.м.н., доцент кафедры морфологии МБФ РНИМУ им. Н.И. Пирогова, Москва
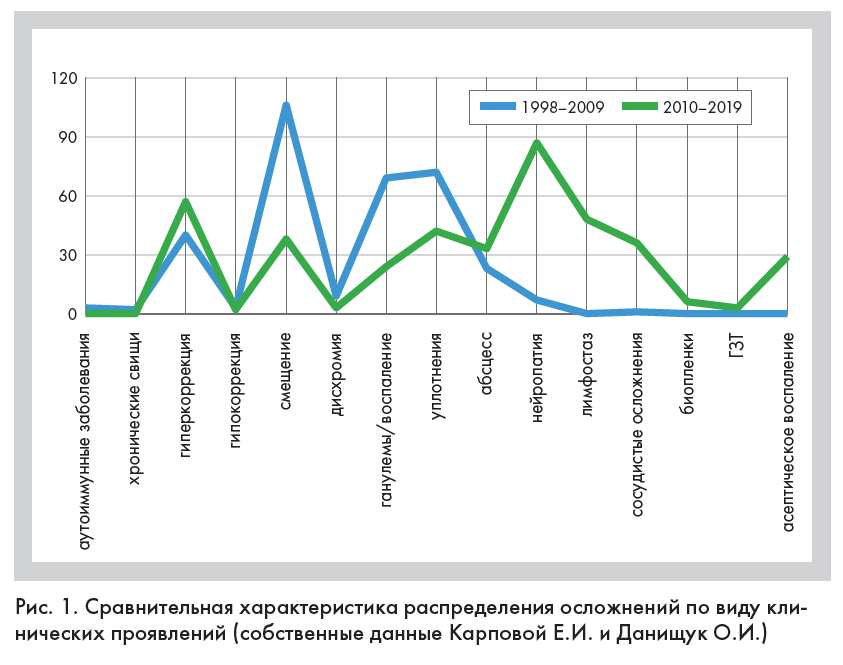
Воспалительные реакции относятся к нежелательным явлениям в практике врача эстетической медицины. Они могут быть причислены к ранним осложнениям, если развиваются в срок до четырех недель после вмешательства, и отсроченным, когда появляются после этого времени. По нашим данным, за последние 10 лет воспаление все чаще стало встречаться в ряду негативных последствий косметических манипуляций. Практика показывает, что в косметологии из всего разнообразия форм воспалительных реакций наиболее часто встречаются абсцессы, свищи, гранулемы и асептическое воспаление (рис. 1).
По определению ведущего российского патолога Струкова А.И. (2010), воспаление – комплексная местная сосудисто-мезенхимальная реакция на повреждение ткани, вызванная действием различного рода агентов [1].
С точки зрения биологической целесообразности воспалительная реакция направлена на сохранение жизнедеятельности организма, восстановление структуры и функции поврежденных тканей. При этом она может
сопровождаться негативными явлениями – гибелью собственных клеток, нарушением структуры и функции отдельных органов, тканей, образование гранулем, рубцов и спаек.
Воспаление – местное проявление общей реакции, в которой участвуют нервная, эндокринная и иммунная системы [2]. Клетки, осуществляющие воспалительную реакцию, являются участниками неспецифической (врожденной) и специфической (иммунной) защиты, а цитокины, выделяемые ими, считаются общими сигнальными молекулами для трех вышеупомянутых регуляторных систем.
Установлено, что у кожных покровов система врожденного иммунитета преобладает над специфическим и направлена на раннюю элиминацию чужеродного агента. При этом проявление защитной функции адаптивного иммунитета в кожных покровах может превысить его целесообразность и привести к нарушению баланса иммунокомпетентных клеток [3, 4].
Патогенез воспаления
Любой воспалительный процесс проходит три последовательные стадии: фазу альтерации (повреждения), экссудации и пролиферации, которые могут частично перекрываться [1–4]. Смена данных фаз связана с действием медиаторов воспаления.
Медиаторы воспаления. Биологически активные вещества, образующиеся при воспалении и обеспечивающие его регуляцию, инициацию и стадийность. Они делятся в зависимости от источника на тканевые и клеточные, постоянно присутствующие и образующиеся de novo, по механизму действия – на ферменты, свободные радикалы и лиганды для рецепторов, в зависимости от дальности действия – на интра-, пара-,
ауто- и эндокринные [1–4].
Клеточные медиаторы воспаления могут синтезироваться de novo или высвобождаться в активированном состоянии. Они связаны с эффекторными клетками врожденного и специфического иммунитета. К первым относятся лаброциты (они же тканевые базофилы или тучные клетки), тромбоциты и полиморфно-ядерные лейкоциты, ко вторым – макрофаги и лимфоциты.
Медиаторы клеточного происхождения вызывают повышение проницаемости стенки сосудов и активацию фагоцитоза, они обладают бактерицидным действием, вызывают вторичную альтерацию (гистолиз), включают иммунные механизмы в воспалительную реакцию, регулируют пролиферацию и дифференцировку клеток в очаге воспаления, направленные на репарацию [1–4].
К клеточным медиаторам воспаления относят:
• производные арахидоновой кислоты: простагландины, тромбоксины и лейкотриены. Простагландины находятся практически во всех тканях и органах. Они повышают чувствительность ноцицептивных рецепторов к
медиаторам боли – гистамину и брадикинину [1]. Нестероидные противовоспалительные средства снижают выработку простагландинов, препятствуя развитию воспалительного процесса, и понижают болевые ощущения;
• биогенные амины: гистамин, серотонин, адреналин, норадреналин;
• пептиды и белки: вещество Р, нейрокинины, цитокины;
• свободные радикалы: NO, перекиси, активные формы кислорода;
• нуклеотиды: АТФ, АДФ, аденозин.
Тканевые медиаторы воспаления. Синтезируются в печени или почках и с током крови доставляются в очаг воспаления, где активизируются. Тканевые медиаторы повышают проницаемость сосудов, активируют хемотаксис полиморфно-ядерных лейкоцитов, фагоцитоз и внутрисосудистую коагуляцию [1–4].
К тканевым медиаторам воспаления относят:
• каликриин-кининовую систему. Кинины «выявляют» чужеродное тело по его отрицательному заряду, на котором адсорбируется фактор Хагемана, имеющий сродство к негативно заряженным поверхностям и относящийся к системе свертывания крови. Это самый простой и примитивный способ отличать «свое и чужое»;
• свертывающую систему крови;
• систему комплемента – группы протеолитических ферментов, активизация которых происходит каскадом и сопровождается развитием атакующего комплекса на мембране клетки-мишени, опсонизацией микроорганизмов, что привлекает к ним фагоцитов. При этом формируются циркулирующие комплексы антиген/антитело.
Медиаторы плазменного и клеточного происхождения взаимосвязаны и работают по принципу аутокаталитической реакции с обратной связью. Смена одних медиаторов другими обусловливает смену клеток в очаге воспаления – от полиморфно-ядерных лейкоцитов и фибробластов до макрофагов, призванных для репарации тканей [1].
Антимедиаторы воспаления. К ним относят: полисахариды (гепарин, хондроитинсульфаты); ингибиторы протеаз (a1-антитрипсин, a2-микроглобулин, ингибиторы комплемента и плазмина, трансформирующий фактор роста β); антифосфолипазы (липокортин); антиоксиданты (сульфгидрильные и металлосодержащие белки, например, церулоплазмин, гаптоглобин, гемопексин, транскобаламин, пероксидаза, С-реактивный белок, а также витамины А, С, Е); инактиваторы воспалительных медиаторов (арилсульфатаза, гистаминаза, киназа); гистамин (который действует на Н2-рецепторы по принципу отрицательной обратной связи, что
вызывает противовоспалительный эффект); полиамины (кадаверин, путресцин, спермин и спермидин); интерлейкин-10 и глюкокортикостероиды [4–5].
Фаза альтерации. Начинается с повреждения ткани и инициирует начало воспаления. Альтерация – это нарушение структуры клеток, тканей, а также субклеточных структур, приводящее к изменению их метаболизма и как след ствие – функции и дезадаптации [1–4].
Разделяют первичную альтерацию – зону повреждения, соответствующую области воздействия воспалительного или флокогенного фактора (например, некроз) и вторичную – вызванную воздействием медиаторов воспаления, на которую флокогенный фактор практически не влияет (например, повреждение клеток в демаркационной зоне воспаления).
Флокогенные факторы. Могут быть физической, химической и биологической природы [4–6]. Выраженность воспалительной реакции зависит от природы повреждающего агента и прямо пропорциональна интенсивности его действия. Наиболее часто врачи эстетической медицины сталкиваются с воздействием физических факторов – механической травмой тканей (прокол, разрез) и внедрением инородных тел
(филлеры, нити). К химическим факторам в косметологии можно отнести вещества, используемые для пилингов и входящие в состав уходовых и лечебных косметических средств, – органические или неорганические кислоты и щелочи, лекарственные средства, вводимые в ткани, и некоторые витамины.
Биологические агенты – одна из наиболее распространенных причин воспаления. К ним относятся вирусы, бактерии, грибы и их сообщества (биопленки), одно и многоклеточные паразиты, а также иммуноаллергические образования, такие как комплекс антиген/антитело, генетически чужеродные структуры (денатурированные белки – погибшие участки собственных тканей), инфицированные вирусом, или опухолевые клетки, токсины насекомых, животных, растений.
В последнее время в косметологии большое внимание уделяется биопленкам (анг. – biofilm), которые могут выступать как в качестве самостоятельного флокогенного фактора, так и способствовать возникновению
осложнений – воспалительного очага в области косметического вмешательства, а также замедлять заживление ран [6–9]. Образование биопленок возможно при введении любых и в особенности длительно действующих (перманентных) филлеров. Поскольку биопленки сложно обнаружить и тем более устранить, необходимо сосредоточить усилия на мерах профилактики, определении факторов риска и их
минимизации.
Биопленка – сообщество микробов нескольких видов, которые прикрепляются к абиотической или биотической поверхности и погружены в экстрацилиарный матрикс, который они секретируют [6]. Биопленки могут
появляться как на поверхности, так и внутри живых тканей, а также на неорганических материалах – имплантатах, иглах, канюлях, шовном материале, катетерах (рис. 2).
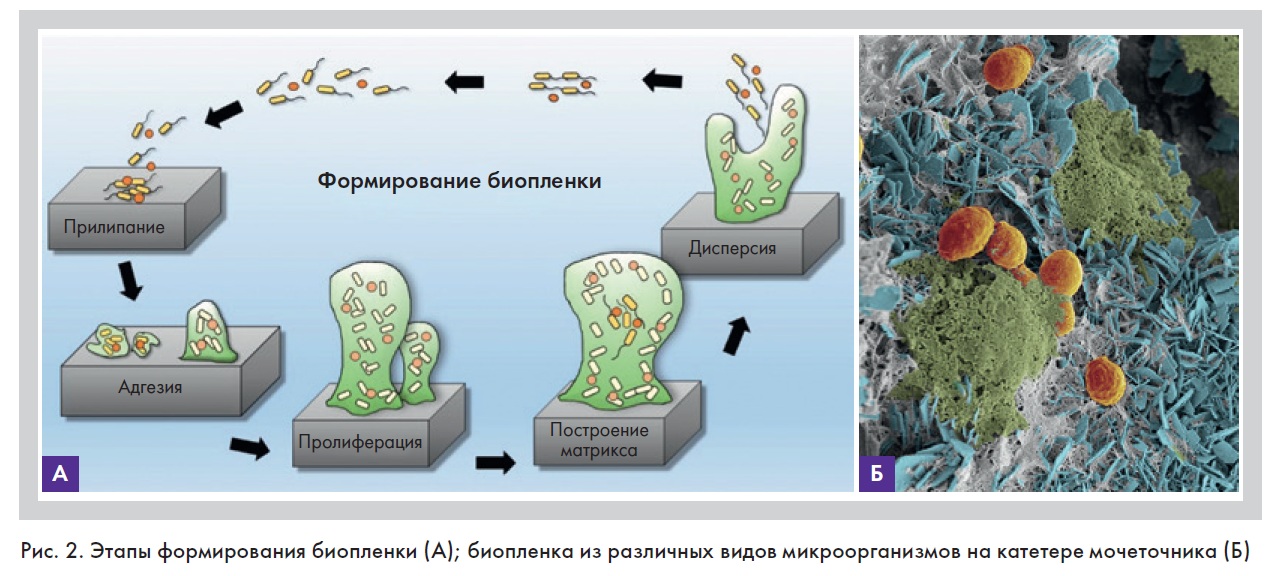
С точки зрения эволюции основная функция биопленки – защита ее обитателей от антибиотиков и фагоцитоза. На сегодняшний день установлено, что 95% микробов существуют в виде биопленок, а образованный ими матрикс 100-кратно увеличивает резистентность биопленки к антибиотикам [9]. В 1970 г. немецкий ученый Нельсон открыл специальные сигнальные пептиды межмикробного общения внутри биопленок, которые он назвал Quorum sensing – «чувство кворума» [6]. То есть микроорганизмы пограничных слоев могут «предупредить» других обитателей колонии о столкновении с антибиотиком и даже на основании собственного опыта «подсказать» способы борьбы с ним. Внутри биопленок происходит активный транспорт веществ, направленный на их самоподдержание и обмен генетической информацией. Недавно
выяснили, что биопленка генерирует сигналы, которые проявляются изменением ее электрического поля [6]. В отсутствие активирующих факторов биопленка впадает в пассивное состояние, и метаболизм ее замирает, активизация может возникнуть при поступлении новых микроорганизмов (инфекция) и воздействии физических факторов (травма, сдавление, нагревание) [9].
С учетом вышеизложенного к методам борьбы, предупреждающим развитие новых или активизацию уже имеющихся биопленок, можно отнести вещества, которые, во-первых, не допустят адгезию микробов; во-вторых, не дадут им «общаться»; в-третьих, заблокируют синтез самой биопленки (такие свойства выявлены у антибиотика – кларетомицина, который предлагается использовать в комплексной противоинфекционной терапии); в-четвертых, это давно известные физические методы борьбы с микробами (высокие температуры, ультрафиолет, дезинфицирующие растворы), которые не всегда могут быть применимы к живым тканям [6–9].
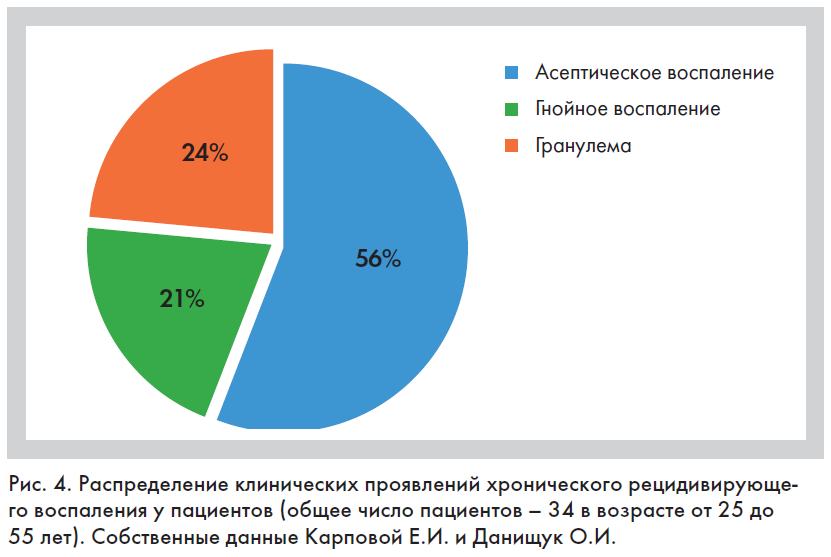
По нашим данным, биопленки после КИП (контурной инъекционной пластики) могут проявляться как асептическое воспаление в виде эритематозных узелков и папул (рис. 3, 4); как бессимптомно протекающие рецидивирующие гранулемы, которые иногда могут проходить сами, иногда оставлять после себя рубцы или локальное обесцвечивание кожных покровов, сопровождаться лимфостазом, эритемой и болезненными ощущениями. Биопленки могут также привести к локальным или разлитым гнойным процессам – абсцессу или флегмоне.
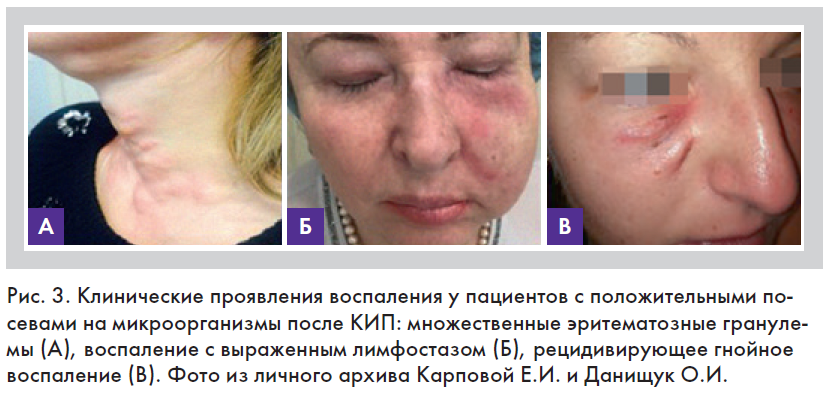
На сегодняшний момент нет четких рекомендаций, как полностью устранить риск образования биопленки, но есть определенные правила асептики, которые нужно соблюдать во время проведения инъекций. Во-первых, важно выяснить у пациента, были ли у него ранее имплантированы постоянные или неразлагаемые наполнители, так как в этом случае имеется больший риск инфицирования, если они соседствуют
с другими филлерами. Возможно, это связано с повреждением во время инъекции сформировавшейся вокруг старого материала соединительнотканной капсулы. Во-вторых, следует избегать введения большого объема материала, так как это может вызывать значительное воспаление за счет увеличения интенсивности воздействия флокогенного фактора, о чем мы упоминали выше.
В-третьих, при отборе пациентов нужно помнить, что в группу риска попадают люди, имеющие очаги хронической инфекции в зубочелюстной системе и ЛОР-органах, а также вирусоносители из-за перекрестного лимфообращения между анатомическими структурами лицевого отдела черепа.
Фаза экссудации. Проникновение элементов крови (плазмы и форменных элементов) через стенку кровеносного сосуда в ткань с образованием экссудата. Экссудат – жидкость, богатая белком (относительная плотность – более 1,015, концентрация белка – более 30 г/л), в которой могут присутствовать форменные элементы крови (чаще всего лейкоциты). Присутствие экссудата характерно только для воспаления [1–4].
Фаза экссудации в своем развитии проходит несколько этапов: 1-й – реакция микроциркуляторного русла; 2-й – повышение сосудистой проницаемости; 3-й – экссудация составных частей плазмы крови и изменение реологических свойств крови; 4-й – миграция клеток крови (фагоцитоз и образование воспалительного клеточного инфильтрата) [1–4].
1. Реакция микроциркуляторного русла. Сразу после воздействия флокогенного фактора в зоне альтерации наблюдается рефлекторный спазм, что приводит к ишемии очага воспаления, далее спазм сменяется артериальной гиперемией, что обусловливает повышение температуры (calor) и покраснение (rubor) воспаленного участка (рис. 5). Потом ток крови опять замедляется, эта фаза называется «венозная гиперемия», которая опять сменяется стазом. Блокада отводящих кровеносных и лимфатических сосудов выполняет роль барьера, предупреждающего генерализацию процесса [1–4].
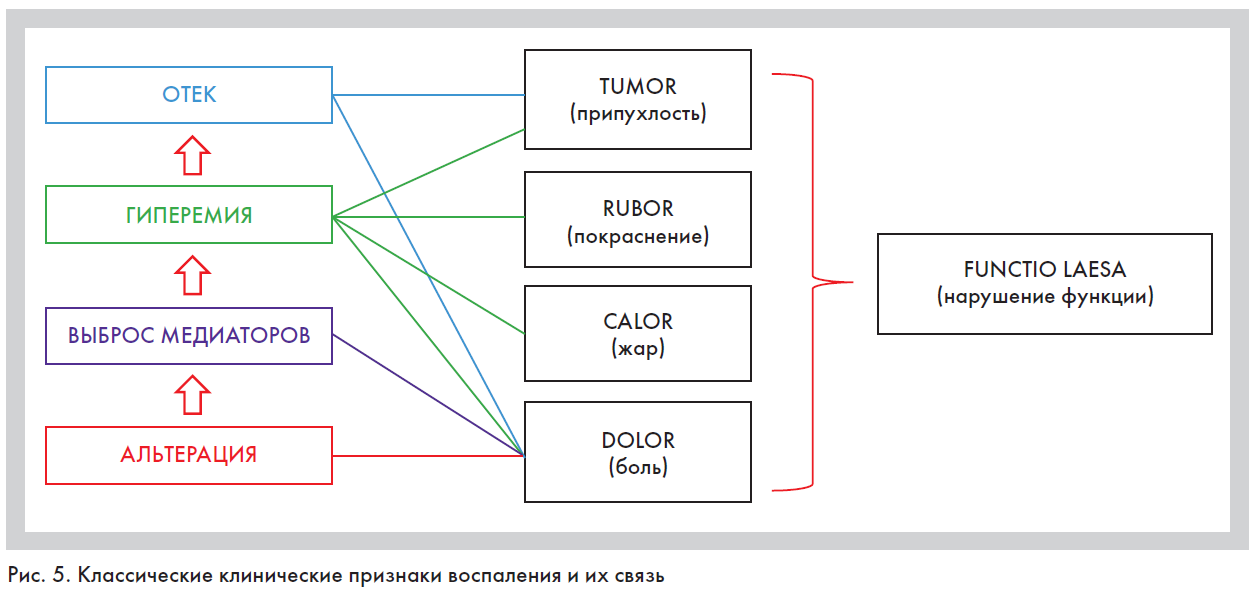
2. Экссудация составных частей плазмы крови, или экстравазация. Сопровождается выходом за пределы сосуда жидких составных частей крови: воды, белков, электролитов. Накопление экссудата в тканях ве-
дет к увеличению ее объема (tumor), сдавлению нервных окончаний и появлению боли (dolor). Возникновение последней при воспалении связывают и с воздействием медиаторов боли (брадикинин), и с нарушением функции ткани или органа (functio laesa) (рис. 5).
3. Изменение реологических свойств крови и выход форменных элементов в ткани. Третий этап заключается в нарушении распределения клеточных элементов крови в венулах и посткапиллярах при замедлении тока крови. Полиморфно-ядерные лейкоциты (нейтрофилы) при этом собираются в краевой зоне и «выстраиваются» вдоль стенки сосуда. Краевое расположение сменяется краевым стоянием (маргинацией), далее следует этап роллинга (качения), плотного прикрепления к эндотелию и миграция за пределы сосуда (рис. 6) [10]. Экспериментально показано, что миграция нейтрофилов в очаг воспаления отмечалась уже через 25–40 минут и достигала максимума через 3–6 часов после альтерации. На пике нейтрофилзависимой фазы начиналась миграция мононуклеаров и лимфоцитов. Примерно через сутки после альтерации мононуклеары (макрофаги) становились доминирующими клеточными элементами инфильтрата, что завершалось окончательной стерилизацией очага воспаления и его очисткой от продуктов тканевого распада [11]. Далее следовали внесосудистые этапы функционирования форменных элементов крови – хемотаксис и фагоцитоз.
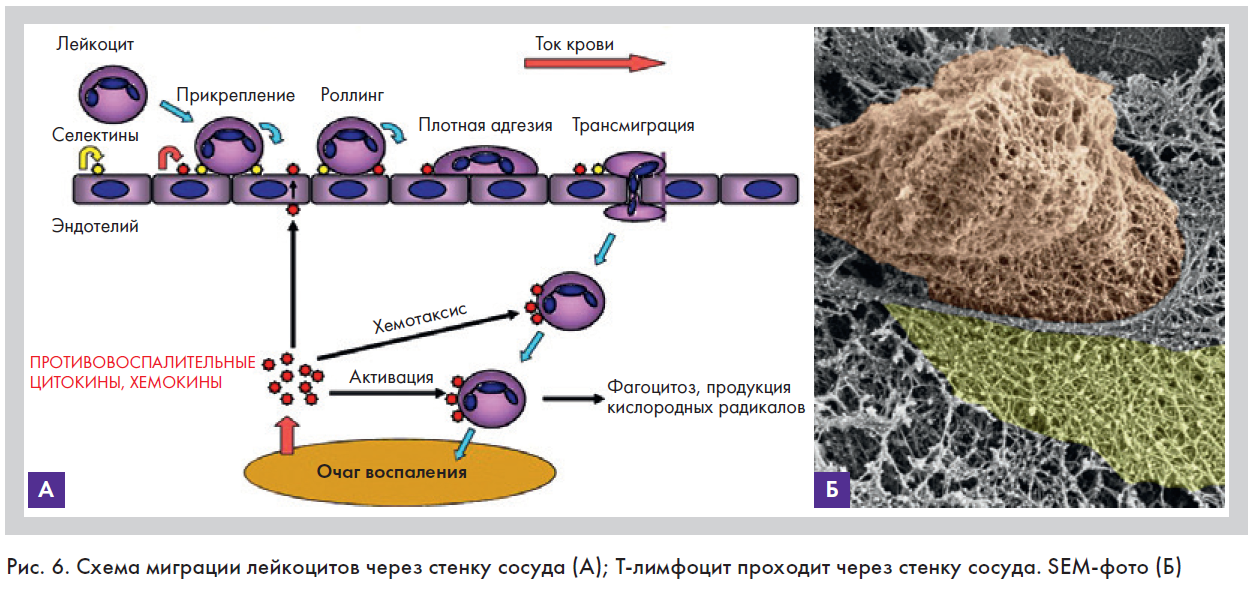
4. Фагоцитоз. Фагоциты – клетки, способные к фагоцитозу, – подразделяют на микро- и макрофаги. К первым относят гранулоциты (базофилы, эозинофилы, нейтрофилы), ко вторым – моноциты. У кожного покрова выявлены три популяции макрофагов: 1-я – оседлые макрофаги кожи, к которым относят клетки Лангерганса (они же внутриэпидермальные дендритные клетки); 2-я – внутриэпидермальные дендритные клетки; 3-я – макрофаги кожи (гистиоциты) [10].
Фагоцитоз – сложный и многоэтапный процесс. Он начинается со сближения фагоцита с клеткой-мишенью (хемотаксис), затем происходит «прилипание» фагоцитирующей клетки к поверхности микроорганизма (раcпознавание рецепторами фагоцита опсонинов), погружение объекта в цитоплазму фагоцита с образованием фагосомы, переваривание лизосомальными ферментами (или киллинг-эффект, деградация объекта) и, наконец, экзоцитоз, или выброс продуктов деградации [2]. Для выполнения своих функций фагоциты нуждаются в помощи опсонинов (белков-стимуляторов) и поддержке Т-хелперов. Еще до контакта с фагоцитом антиген (в данном случае микроб) покрывается белковыми факторами системы комплемента, а также антигенспецифичным антителом классов G и М (IgG и IgM). Этот процесс называется «опсонизация», причем белки системы комплемента могут нападать на микробов непосредственно через формирование мембраноатакующего комплекса, повреждающего стенки бактерий, но основное действие комплемента – активация фагоцитов и «наводка» их на объекты. Фиксированные на поверхности микроба антитела (IgG и IgM) также «метят» его с помощью Fc-рецепторов, поскольку у фагоцитов имеются к ним комплементарные лиганды. Установлено, что в процессе опсонизации могут участвовать и другие малоспецифичные к антигенам гуморальные защитные факторы, например С-реактивный белок [3].
Виды экссудативного воспаления
Виды экссудативного воспаления различаются в зависимости от характера экссудата и локализации воспаления. Выделяют серозное, гнойное, фибринозное, гнилостное, геморрагическое и смешанное виды экссудативного воспаления [1–4]. Первые два наиболее часто встречаются в практике врача эстетической медицины, остальные становятся объектами для врачей-инфекционистов, дерматологов и хирургов гнойных отделений.
Серозное воспаление. Образование серозного экссудата характерно для большинства заболеваний кожи, имеющих аллергическую природу, а также после специфического воздействия физических и химических факторов. Экссудат в этом случае представляет собой прозрачную жидкость желтоватого цвета с низкой удельной массой (1,018–1,020), содержащую до 5% мелкодисперсных белков (альбуминов) и незначительное
количество клеточных элементов (лейкоцитов) [12]. Иногда экссудат накапливается под эпидермисом и отслаивает его от подлежащей ткани с образованием пузырей. Исход серозного воспаления обычно благоприятный, но при хроническом его течении он может приводить к склерозу, а при присоединении инфекции он переходит в гнойное воспаление.
Гнойное воспаление. Экссудат при этой форме воспаления содержит микроорганизмы, большое количество функционирующих и погибших лейкоцитов, клетки поврежденных тканей, белки, липиды, холестерин, кетоновые тела, дезоксирибонуклеиновую кислоту [1–4]. Консистенция и цвет гноя зависят от длительности процесса и вида возбудителя: в свежих случаях гной более жидкий, а при застарелых формах – более сгущенный, при стафилококковой инфекции он желтоватый, стрептококки дают зеленоватую окраску, Candida albicans – белую. Характерной особенностью гнойного воспаления является гистолиз, обусловленный воздействием на ткани протеолитических ферментов нейтрофилов. В практике врача эстетической медицины могут встречаться следующие разновидности гнойного воспаления:
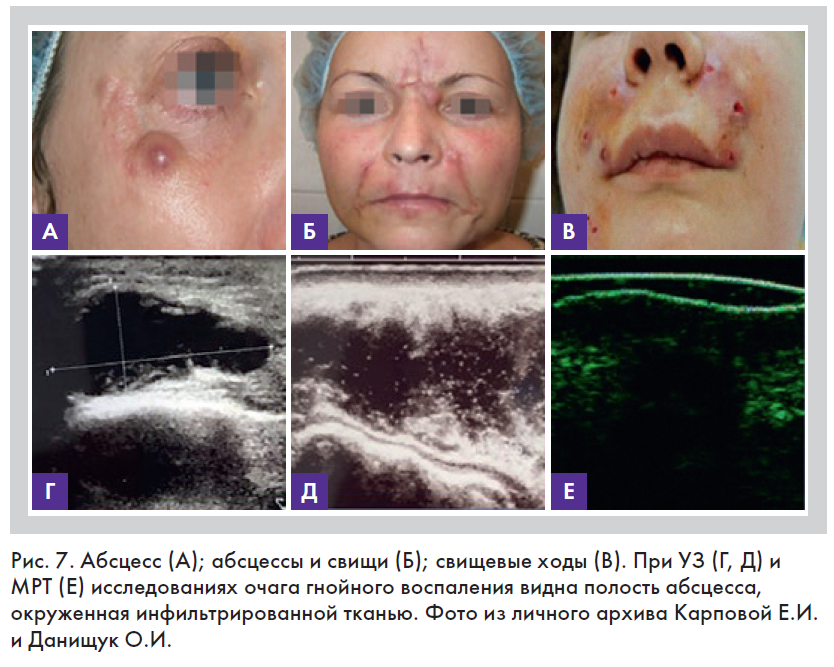
• абсцесс – очаговое гнойное воспаление с локальным уплотнением кожи и флюктуацией в центре, характеризуется образованием полости, заполненной гноем (рис. 7). Гнойник со временем отграничивается валом
грануляционной ткани, богатой капиллярами, через стенки которых происходит усиленная миграция лейкоцитов. Образуется оболочка абсцесса, состоящая снаружи из соединительнотканных волокон, прилежащих к неизмененной ткани, а внутри – из грануляций и выделяемого ими гноя. Оболочку абсцесса, продуцирующую гной, называют пиогенной мембраной. Несмотря на наличие капсулы, абсцесс может расширяться (разливаться) или вскрываться с выходом гноя в окружающую среду или внутренние полости [12];
• флегмона – разлитое гнойное воспаление, при котором экссудат распространяется диффузно между тканевыми элементами, пропитывая, расслаивая и лизируя ткани. Различают мягкую и твердую флегмону. Мягкая характеризуется отсутствием видимых очагов некроза ткани, твердая – наличием таких очагов, которые не подвергаются гнойному расплавлению, вследствие чего ткань становится очень плотной. Флегмона подкожной жировой клетчатки называется панникулит и приводит к разрушению жировых клеток и замещению их соединительной тканью с образованием узлов, бляшек или инфильтратов. Возможно развитие асептической флегмоны при попадании в ткань некоторых химических веществ [12];
• свищ – канал, высланный грануляционной тканью или эпителием, осумкованный ход, соединяющий очаг гнойного воспаления с внешней средой. В косметологии часто развивается в ответ на присутствие инородного тела (рис. 7) [12];
• фурункул – гнойное воспаление одной волосяной луковицы с прилегающими сальными железами и окружающей их рыхлой соединительной тканью. Множественное воспаление волосяных луковиц носит название фурункулез. Может развиться на волосяных фолликулах ресниц и реже бровей;
• карбункул – гнойное воспаление нескольких волосяных луковиц с прилегающими сальными железами и соединительной тканью. Исход гнойного воспаления зависит от размеров площади поражения, характера течения, вирулентности микроба и исходного состояния организма. В неблагоприятных случаях может наступить генерализация инфекции, развивается сепсис. Если процесс отграничивается, абсцесс вскрывается
спонтанно или хирургически – его полость заполняется грануляционной тканью, которая созревает, и на месте гнойника образуется рубец. Возможен и другой исход – гной в абсцессе сгущается, превращается в некротический детрит, подвергающийся петрификации. Длительно протекающее гнойное воспаление может приводить к амилоидозу. Гистолиз (разрушение ткани) делает возможным распространение гнойного
процесса контактным, лимфогенным и гематогенным путем [12]. Гнойное воспаление лежит в основе многих заболеваний кожи, а также осложнений после косметических манипуляций.
Фаза пролиферации
Пролиферация (от латинского proles – потомство, fero – несу) начинается по периферии очага воспаления с образованием грануляционной ткани (от латинского granulum – зернышко). Центр гранулы представлен капилляром, сформированным из эндотелиальных клеток, окруженных соединительнотканными элементами. Узелки грануляционной ткани сливаются и образуют демаркационный вал – барьер, отделяющий очаг воспаления от здоровой ткани. Рост и размножение эпителиальных клеток и элементов ретикулоэндотелиальной системы регулируется факторами роста, вырабатывающимися в стадию альтерации, медиаторами
воспаления, минералокортикоидными гормонами надпочечников [4].
Со временем грануляционная ткань «созревает», при этом в ней уменьшается количество кровеносных сосудов, нервные окончания атрофируются и грануляционная ткань превращается в рубцовую. В случаях сравнительно небольших повреждений воспаление завершается полным восстановлением структуры и функции ткани (заживление по первичному натяжению), при обширных повреждениях дефект замещается рубцовой тканью (заживление по вторичному натяжению) [10].
Классификация воспаления по морфологическим признакам и патогенезу
• По длительности процесса воспаление делится на: острое – до 2 месяцев, подострое от 2 до 6 месяцев, хроническое – более 6 месяцев (может быть продолжением острого воспаления или формироваться как первичное хроническое воспаление).
• По этиологии: септическое (микробное), которое в свою очередь делится на специфическое – развивается на определенный возбудитель (туберкулез, сифилис, лепра, брюшной тиф и прочие) – и неспецифическое, вызванное гноеродной флорой (стафилококками, стрептококками, кишечной палочкой и прочими); асептическое воспаление (о котором мы расскажем далее).
• По морфологическим проявлениям: экссудативное и пролиферативное (или продуктивное), в зависимости от преобладания соответствующей фазы воспаления. В настоящее время суще-
ствование альтеративной формы воспаления отрицается большинством патологов на том основании, что при этом отсутствует сосудисто-мезенхимальная реакция (экссудация и пролиферация), которая и составляет сущность воспалительной реакции. Таким образом, речь в данном случае идет не о воспалении, а о некрозе [1].
Пролиферативное (продуктивное) воспаление
Пролиферативное (продуктивное) воспаление характеризуется преобладанием пролиферации клеточных элементов над экссудацией. Морфологическими признаками продуктивного воспаления будут являться инфильтрация ткани мононуклеарными клетками, заживление очага воспаления путем замещения поврежденной ткани соединительной, завершающейся пролиферацией мелких кровеносных сосудов (ангиогенезом) и фиброзом [1]. Экспериментально установлено, что к концу первой недели от момента повреждения в зону воспаления врастают капилляры, на второй неделе формируется простая сосудистая
сеть и к концу 30-х суток появляется сформированная сосудистая сеть [7]. Миграция фибробластов в очаг воспаления начинается через 1–3 суток от момента альтерации, еще через 2–3 суток происходит активное формирование ими коллагеновых волокон и других составляющих экстраклеточного матрикса [3].
Выделяют следующие виды пролиферативного воспаления: межуточное (интерстициальное); с образованием полипов и остроконечных кондилом; гранулематозное [1]. Первое чаще встречается во внутренних органах, второе наблюдается в области слизистых или на границе перехода кожи в слизистую оболочку. Эти типы воспаления становятся объектом лечения у дерматовенерологов и проктологов.
Последнее – гранулематозное воспаление – достаточно часто встречается как осложнение после инвазивных косметических процедур (рис. 1).
Гранулематозное воспаление
Характеризуется образованием гранулем (узелков), возникающих в результате пролиферации и трансформации фагоцитов (рис. 8) [13–15]. Для развития гранулемы необходимы следующие условия: наличие
веществ, способных стимулировать систему моноцитарных фагоцитов, их созревание и трансформацию, а также стойкость антигена к лизосомальным ферментам фагоцитов и достаточный объем флокогенного фактора [13].
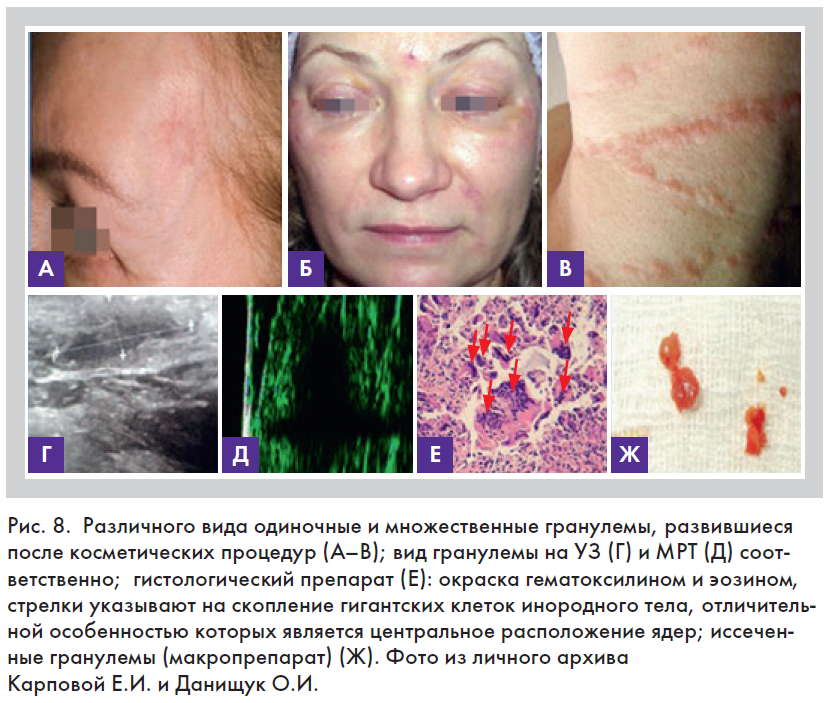
Созревание гранулемы проходит в несколько стадий: сначала в очаге накапливаются макрофаги (образование макрофагальной гранулемы); далее происходит созревание и трансформация макрофагов в эпителиоидные клетки (образование эпителиоидной гранулемы); эпителиоидные клетки и макрофаги сливаются и образуют гигантские клетки, среди которых выделяют две разновидности – клетки инородных тел и клетки Пирогова-Лангханса, у которых может насчитываться от 2 до 100 ядер и более (рис. 8).
Первых отличает центральное и равномерное расположение многочисленных ядер, у вторых ядра расположены эксцентрично преимущественно по периферии [13–15].
Гранулема инородного тела представляет собой реакцию кожи на попадание в нее различных экзогенных субстанций. В зависимости от характера вещества гранулемы инородных тел подразделяются на травматические (металлы, стекло, графит, колючки растений, дерево, амальгама, пластик, волосы, ногти, эпидермис и др.), профессиональные (кремний, бериллий, волосы, стекловолокно и др.), косметические (силикон, коллаген, парафины, цирконий, растительные масла, краски для татуажа, гидроксиапатит кальция и др.), ятрогенные (шовные материалы, металлы, тальк, крахмал, желатин и др.), инъекционные (инсулин, витамин К, вакцины, соли кальция, кортикостероиды, поливинилпирролидон, наркотические анальгетики, тальк и др.) [13–15].
По нашим наблюдениям, гранулемы инородных тел, образу.щиеся как осложнения после КИП, не всегда, но, как правило, локализуются в местах проколов и могут быть похожи на небольшие возвышения кожного покрова, бляшки разнообразной формы или папулы, которые могут отличаться или нет от цвета остальной кожи (рис. 8). Гранулемы могут изъязвляться, нагнаиваться, расти с образованием псевдоопухоли, некротизироваться или самопроизвольно исчезать.
Диагноз гранулемы, возникшей в результате реакции на введение филлера, ставится на основании гистологического исследования, клинической картины и анамнеза. В отличие от наблюдаемого практически в 100% случаев факта инкапсуляции филлера гранулема очень часто сопровождается хронической воспалительной реакцией. Развитие гранулемы обычно происходило спустя 6–24 месяцев после процедуры и сопровождалось отеком, эритемой или изменением цвета кожи на месте имплантации. Наши наблюдения показывают, что среди возможных причин развития гранулемы после КИП можно рассматривать введение
избыточного объема препарата за одну процедуру, введение нового филлера поверх уже имеющегося, особенно в случае перманентных наполнителей, наличие примесей в составе препарата.
Распространенными методами диагностики гранулем являются УЗИ, рентгенография, компьютерная томография, но наиболее точным – биопсия с последующим гистологическим исследованием (рис. 8).
Показание для хирургического удаления гранулемы – наличие вторичной инфекции, подтвержденной микробиологическими методами, признаки интоксикации, близкое расположение к крупным сосудам и нервам, постоянный болевой синдром, выраженная реакция гиперчувствительности, косметический дефект и др.
Асептическое воспаление
Это воспаление возникает при воздействии факторов механической, физической или химической природы, но без участия микробов [4]. Развитие асептического воспаления в практике врача эстетической медицины чаще всего происходило при закрытых механических или химических повреждениях, к которым можно отнести введение филлеров и нитей и аллергической реакции на их компоненты, а также при использовании лазеров, пилингов и других инвазивных косметических методик, включая ультрафиолетовое облучение (рис. 9).
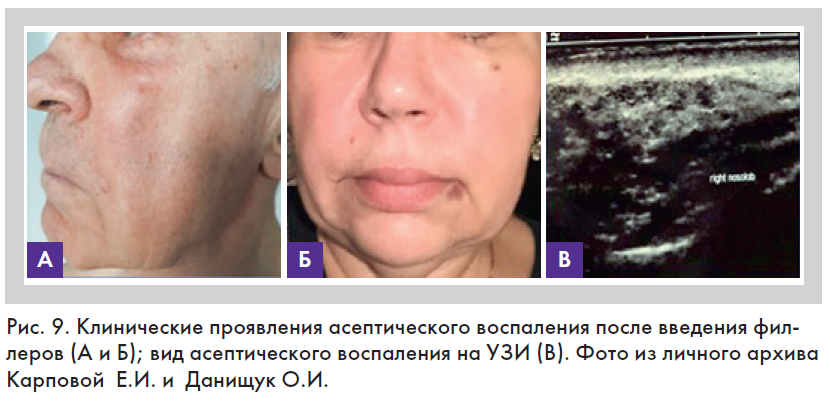
В зависимости от преобладания той или иной фазы асептические воспаления можно разделить на экссудативные и пролиферативные. Помимо этого к асептической форме воспаления могут быть отнесены аллергические реакции. Аллергическое воспаление характеризуется острым течением и чаще всего сопровождается появлением серозного или серозно-фибринозного экссудата.
Отличительной особенностью асептических воспалений в практике врача эстетической медицины является проявление только местных (за исключением аллергических) клинико-морфологических изменений, которое ограничено зоной инъекции или воздействия. Оно может быть двухсторонним или односторонним и обычно сопровождается локальным покраснением и уплотнением тканей над зоной воздействия (рис. 9). Общая реакция организма, проявляющаяся повышением температуры тела, учащением пульса, дыхания и нейтрофильным лейкоцитозом, отсутствует. Однако при выраженной экссудативной реакции может появиться непродолжительная по времени (до 24 ч) асептическая резорбтивная лихорадка, характеризующаяся повышением температуры тела на 0,5–1°С, но без учащения пульса и нейтрофильного лейкоцитоза. При воспалении аллергической природы, кроме местных клинических признаков, наблюдаются и общие изменения в состоянии организма в виде повышения температуры тела и учащения пульса, однако при этом нейтрофильный лейкоцитоз также отсутствует.
Наш клинический опыт показывает, что в зону риска в плане развития асептического воспаления, как осложнения после КИП, попадают пациенты с иммунодефицитными состояниями – в первую очередь это лица пожилого возраста, имеющие хронические или аутоиммунные заболевания, очаги инфекции в зубочелюстной системе и ЛОР-органах, с нарушением противоопухолевого иммунитета, в анамнезе у которых были выявлены доброкачественные и тем более злокачественные новообразования.
И в заключение
Воспаление – универсальная, генетически запрограммированная реакция организма на повреждения различной природы. Его суть заключается в концентрации фагоцитов и других защитных факторов в зоне повреждения и ликвидации биологически агрессивного материала, а также в восстановлении структуры и функций пострадавшей ткани. Иммунная система – главный противовоспалительный механизм и наиболее уязвимая система в условиях иммунодефицита.
ЛИТЕРАТУРА
[1] Струков А.И., Серов В.В. Патологическая анатомия:учебник. – 5-е изд., стер. – М.: Литера, 2010. – 880 с.
[2] Сапин М.Р., Этинген Л.Е. Иммунная система человека. – М.: Медицина, 1996. – 304 с.
[3] Рабсон А., Ройт А., Делвз П. Основы медицинской иммунологии. – М.: Мир, 2006. – 320 с.
[4] Казмирчук В.Е., Ковальчук Л.В., Мальцев Д.В. Клиническая иммунология и аллергология. – К.: Феникс, 2009. – 524 с.
[5] Fitzgerald R., Bertucci V., Sykes J.M., Duplechain J.K. (2016) Adverse reactions to injectable fillers. Facial Plast Surg 32(5): 532–555.
[6] Kravvas G., Veitch D., Al-Niaimi F. The increasing relevance of biofilms in common dermatological conditions. J Dermatolog Treat. 2018 Mar; 29(2): 202–207.
[7] Ibrahim O., Overman J., Arndt K.A., Dover J.S. Filler Nodules: Inflammatory or Infectious? A Review of Biofilms and Their Implications on Clinical Practice. Dermatol Surg. 2018 Jan; 44(1): 53–60.
[8] Saththianathan M., Johani K., Taylor A., Hu H., Vickery K., Callan P., Deva A.K. The Role of Bacterial Biofilm in Adverse Soft-Tissue Filler Reactions: A Combined Laboratory and Clinical Study. Plast Reconstr Surg. 2017 Mar; 139(3): 613–621.
[9] Sangwan S., Tanwar H., Poonia P. Anti-Biofilm Enzymes: A Strategy to Remove Biofilms. May 2019. – URL: researchgate.net.
[10] Кожа человека (анатомия, гистология, гистопатология): учебное пособие для студентов медицинских вузов / П.А. Гелашвили, А.А., Супильников, В.А. Плохова. – Самара: НОУ ВПО МИ «РЕАВИЗ», 2013. – 168 с.
[11] Lai N.M., Lai N.A., O’Riordan E., Chaiyakunapruk N. et al. Skin antisepsis for reducing central venous catheter-related infections. Cochrane Database Syst Rev 2016:CD010140.
[12] Дерматовенерология: национальное руководство. Краткое издание / под ред. Ю.С. Бутова, Ю.К. Скрипкина, О.Л. Иванова. – М.: ГЭОТАР-Медиа, 2013. – 896 с.
[13] Gandy J., Bierman D., Zachary C. Granulomatous reaction to Belotero Balance: A case study. J Cosmet Laser Ther. 2017 Oct; 19(5): 307–309.
[14] Friedmann D.P., Kurian A., Fitzpatrick R.E. Delayed granulomatous reactions to facial cosmetic injections of polymethylmethacrylate microspheres and liquid injectable silicone: A case series. J Cosmet Laser Ther. 2016 Jun; 18(3): 170–173.
[15] Rzany B., DeLorenzi C. (2015) Understanding, avoiding and managing severe filler complications. Plast Reconstr Surg 136 (5 Suppl): 1960–2030.
[16] Wang Y., Guan A., Isayeva I., Vorvolakos K., Das S., Li Z., Phillips K.S. Interactions of Staphylococcus aureus with ultrasoft hydrogel biomaterials. Biomaterials. 2016 Jul; 95: 74–85.
