О.М. ДЕМИНА, ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Е.И. КАРПОВА, ФГАОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
О.Б. БОРЗЫХ, Красноярский государственный медицинский университет им. проф. В.Ф. Войно-Ясенецкого (КрасГМУ им. проф. В.Ф. Войно-Ясенецкого), Красноярск, Россия
Введение
В последнее время в косметологии и дерматологии появился интерес к тестированию генетических особенностей организма. Такое тестирование стало актуально не только для врача, но и для пациента при выборе алгоритма эффективного проведения процедур. Основную сложность для врача эстетического профиля представляет интерпретация полученных результатов. Врачу необходимо самостоятельно разбираться в полученных результатах генетического тестирования, так как лаборатории не предоставляют расширенную интерпретацию по каждому пациенту с учетом индивидуальных особенностей. Как правило, врач получает автоматизированный отчет без привязки к конкретному пациенту. Наша задача при работе с пациентами использовать отчет по генетическому тестированию как один из дополнительных этапов диагностики. Таким образом, на основании полученных данных, анамнеза, осмотра, дополнительных методов исследования, включая аппаратную диагностику кожи и результатов генетического тестирования, врач может составить индивидуальный план работы с пациентом [1]. Кроме того, результаты генетического тестирования можно применять при решении вопроса о конкретных эстетических процедурах и прогнозах их эффективности. Например, можно опираться на результаты полученных анализов при выборе степени агрессивности воздействия таких процедур, как пилинг или лазерная шлифовка кожи.
Таким образом, необходимость генетического тестирования и понимание его результатов становятся актуальными при работе с пациентом в косметологии. Косметологу и дерматологу для работы с генетическими тестами необходимо разобраться с общими определениями, существующими в генетике.
Базовые определения медицинской генетики
Согласно определению, медицинская генетика — это область медицины, наука, изучающая наследственность и изменчивость в популяции людей, роль наследственных факторов в возникновении патологии у человека, а также зависимость заболеваний от генетической предрасположенности и условий окружающей среды [2]. Вся генетическая информация об организме (о структуре белков и нуклеиновых кислот) заключена в молекулы ДНК и РНК в виде последовательностей нуклеотидов — это и есть гены [3].
ДНК (дезоксирибонуклеиновая кислота) — одна из трех основных макромолекул, обеспечивает хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов. В молекуле ДНК записан так называемый генетический код, который состоит из нуклеотидов. В свою очередь каждый нуклеотид состоит из азотистого основания, сахара (дезоксирибоза) и фосфатной группы. У человека молекула ДНК состоит из 2 цепочек нуклеотидов, ориентированных друг по отношению к другу азотистыми основаниями, закрученными по винтовой линии [4,5] (рис. 1).
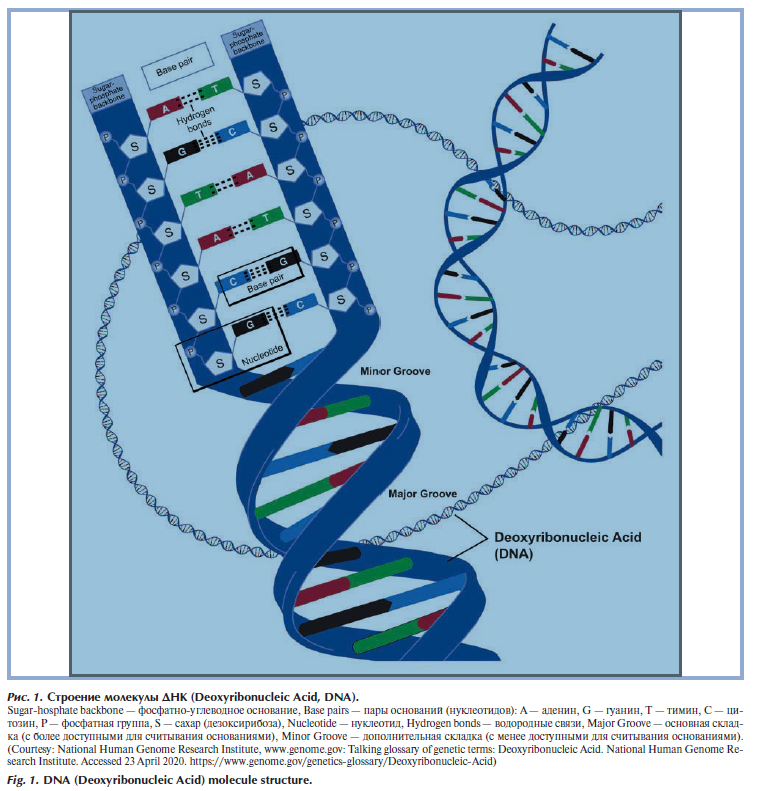
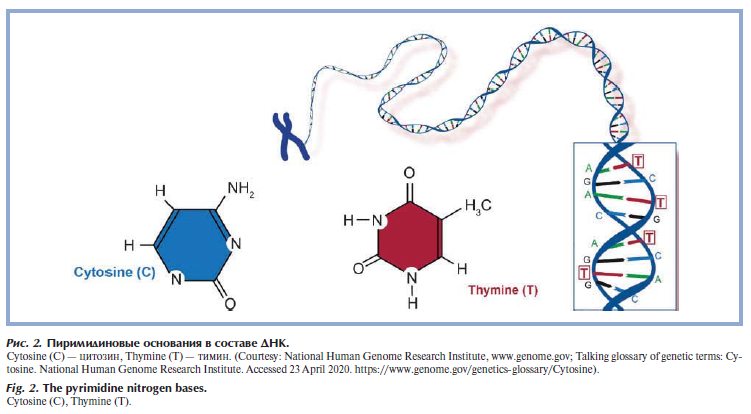
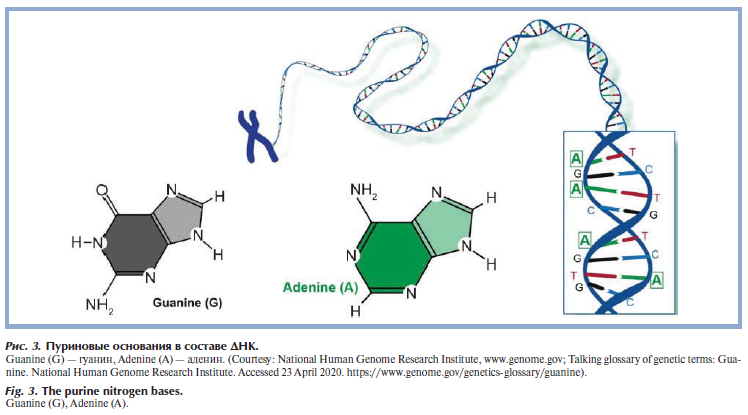
Всего в ДНК встречается 4 вида азотистых оснований: аденин (A), гуанин (Г/G), тимин (T) и цитозин (Ц/C). Азотистыми основаниями нуклеотидов могут быть производные пурина — аденин и гуанин (рис. 2) [6] и производные пиримидина — тимин и цитозин (рис. 3) [7].
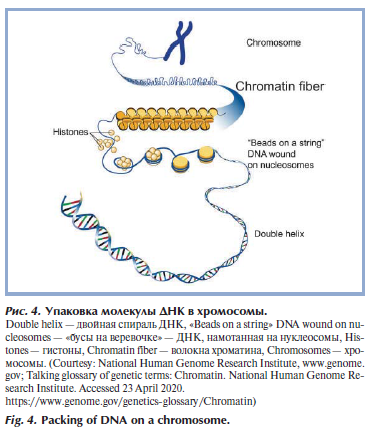
Две цепочки ДНК соединяются между собой водородными связями между азотистыми основаниями. При этом образование связей происходит по принципу комплементарности, т.е. аденин соединяется только с тимином, а гуанин — только с цитозином. Поэтому при расшифровке генотипа указывается последовательность нуклеотидов (генов) только одной цепочки ДНК, вторая комплементарна ей. В клетке цепочки ДНК находятся в составе хромосом. Основа хромосомы — линейная молекула ДНК значительной длины (порядка 2 м). Для размещения ДНК в ядре необходима ее упаковка в хроматин, при этом происходит многократное уменьшениt ее линейных размеров. Сначала происходит накручивание ДНК на нуклеосомы, образовавшаяся нуклеосомная нить компартизуется в фибриллу, а она сворачивается в гигантские петли, закрепленные на белковой скелетной структуре ядра — ядерном матриксе (рис. 4) [8]. Перед делением клетки происходят дальнейшая упаковка и утолщение, и тогда в световой микроскоп в клетке можно рассмотреть хромосомы вида буквы Х (чаще с неравномерными плечами) [9].
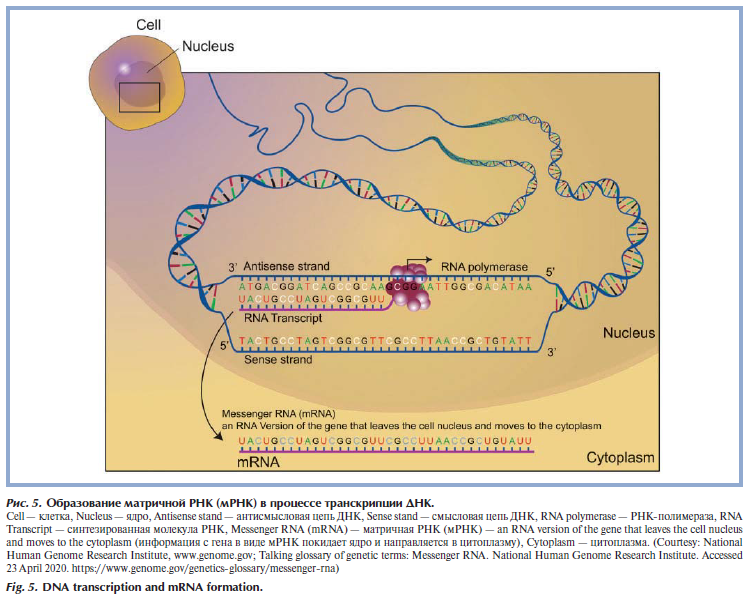
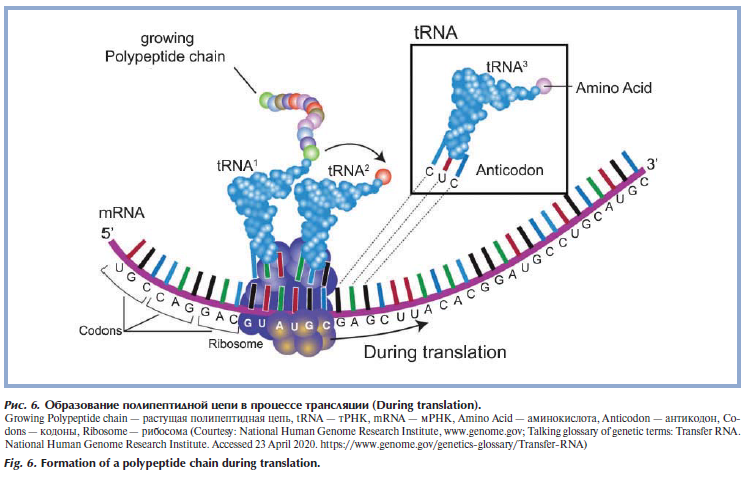
Вторая молекула, обеспечивающая хранение и реализацию генетической программы, — молекула РНК. РНК (рибонуклеиновая кислота) представляет собой одиночную цепочку нуклеотидов, кодирующих генетическую информацию. Нуклеотиды состоят из азотистого основания, сахара (рибозы) и фосфатной группы. В РНК встречается 4 вида азотистых оснований: аденин (A), гуанин (Г/G), цитозин (Ц/C) и урацил (У/U). Нуклеотиды в РНК комплементарны нуклеотидам в ДНК, но аденину комплементарен урацил (вместо тимина). Наиболее важные типы РНК: матричная, или информационная — мРНК (посредник при передаче информации от ДНК к рибосомам, осуществляющим синтез белка) (рис. 5) [10], транспортные — тРНК (переносят специфические аминокислоты к рибосомам) и рибосомальные РНК — рРНК (принимают участие в формировании рибосом) (рис. 6) [11—13].
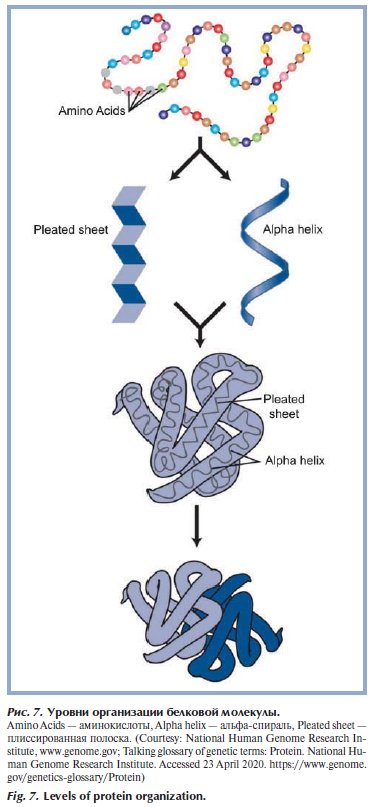
Третья молекула, обеспечивающая хранение и передачу генетической программы, — белок. Белки — это цепочки аминокислот, соединенных пептидной связью (первичная белковая структура). После процесса трансляции на рибосоме структура белковой молекулы подвергается пространственному изменению (рис. 7) [14]. Всего выделяют 4 уровня организации белковой молекулы: первичный — цепь из последовательности аминокислот, вторичный — возникает при образовании водородных связей между аминокислотами, при этом может происходить закручивание по спирали, образуя альфа-спираль или складывание в виде гармошки с формированием плиссированной полоски. Третичная структура — организация и расположение в пространстве молекулы, четвертичная структура — присоединение других полипептидных цепей. Состав аминокислот в белке определяется генетическим кодом, при синтезе используется набор из 20 аминокислот. Функции белков в организме очень разнообразны, для врачей-косметологов наиболее важными белками дермы являются коллаген и эластин.
Генетическая информация, записанная в ДНК, в конечном счете реализуется синтезом биополимеров, из которых состоят клетки. В результате транскрипции информация с ДНК записывается на мРНК, а в результате трансляции собирается
белковая молекула из последовательности аминокислот на рибосоме на основании информации с мРНК.
Для чего описаны некоторые основы? При наличии у пациента нарушения функционирования кожи ошибка может возникнуть на любом этапе передачи информации, и задача изучения результатов генетического теста — максимально полноценно проследить генную сеть, отвечающую за функционирование кожи, и найти потенциальные зоны риска. В отчете по результатам генетического тестирования будет в том числе присутствовать обозначение аллелей генотипов, выраженное через обозначения нуклеотидов (A, G, C, T), и грамотному врачу необходимо понимать базовые определения медицинской генетики.
Генетическая информация
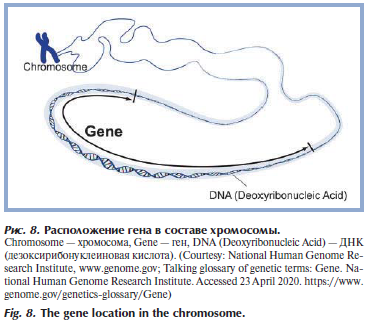
ДНК является материальным носителем генетической информации. Наш геном содержит всю необходимую биологическую информацию, необходимую для построения и поддержания организма [15]. Генетическая информация генома состоит из генов, таким образом, ген — это единица передачи наследственной информации в организме, влияющая на определенную характеристику организма. Ген представляет собой участок ДНК, состоящий из открытой рамки считывания (место, откуда начинается передача его информации на мРНК), информационной части, а также регуляторных последовательностей (рис. 8) [16]. У человека весь наследственный материал представлен 23 парами хромосом в ядре (22 пары
аутосом и пара половых хромосом); кроме того, клетка обладает множеством копий митохондриальной ДНК.
В ходе выполнения проекта «Геном человека» определена последовательность ДНК всех хромосом и митохондриальной ДНК. Полное секвенирование генома (определение нуклеотидной последовательности) выявило, что геном содержит порядка 1,5% активных генов (кодируют белки или функциональные РНК) [17]. Остальная часть генома состоит из некодирующей ДНК (ранее ее называли мусорной ДНК — junk DNA) [18], эта ДНК играет важную роль в регуляции активности генов [19].
Сборка белка из аминокислот на рибосоме происходит согласно генетическому коду. Таким образом, генетический код (Genetic code) — это правила, по которым последовательность нуклеотидов на мРНК переводится в последовательность аминокислот для формирования белковой молекулы. Единица генетического кода, представленная тремя нуклеотидными остатками (триплет) в ДНК или РНК, называется кодоном (кодирующий тринуклеотид). Существует несколько вариантов кодонов (рис. 9) [20]: кодоны, кодирующие определенные аминокислоты [21, 22], старт-кодон — место, откуда начинается синтез белковой молекулы [23], стоп-кодоны (терминаторные) — место окончания синтеза белковой молекулы [24].
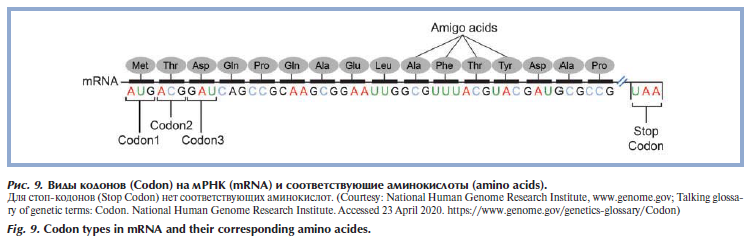
Соответствия кодонов и аминокислот неслучайны [25]. Так, у аминокислот с общим путем биосинтеза, как правило, одинаковая первая позиция кодона, кодоны аминокислот со схожими физикохимическими свойствами также, как правило, похожи, что смягчает последствия мутаций и нарушений трансляций [26, 27].
Ранее упоминалось, что у человека хромосомы (а значит, генетический материал) парные, отсюда происходит еще одно понятие, необходимое при работе с генетическими тестами, — аллели. Аллели — это различные формы одного и того же гена, расположенные в одинаковых участках (локусах) парных хромосом. Аллели определяют направление развития конкретного признака [28]. При этом если в организме присутствуют 2 одинаковых аллеля одного гена, то организм называется гомозиготным, если разные аллели — гетерозиготным (рис. 10) [29].
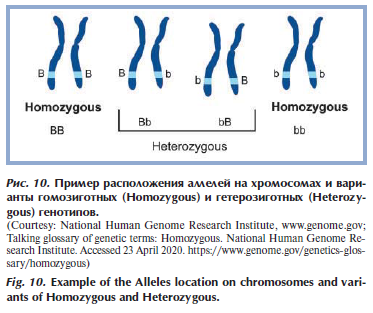
Различают доминантные и рецессивные аллели: доминантные в гетерозиготном организме маскируют или полностью подавляют проявление второго (рецессивного) аллеля. Степень подавления рецессивного признака может быть разная: полное доминирование (полностью подавляется рецессивный признак), неполное доминирование (у гетерозигот появляется промежуточный признак), сверхдоминирование (у гетерозиготы доминантный признак проявляется больше всего), кодоминирование (появление у гетерозиготы нового признака), доминирование, связанное с полом (проявление признака зависит от пола) [28].
Обычно аллели обозначают буквами (часто по первой букве кодируемого гена), при этом доминантный аллель — заглавной (прописной) буквой, рецессивный — маленькой (строчной).
В доступных (на Российском рынке) генетических тестах, применяемых в дерматологии и косметологии, используется обозначение генотипа для определенного локуса гена. При обозначении генотипа указываются варианты нуклеотидов, встречающиеся в гомологичных локусах хромосом на участке того или иного гена; при этом аллели обозначаются заглавными буквами соответствующих нуклеотидов (A, C, T, G). Доминантный аллель — это тот, который чаще встречается в популяции, а рецессивный — тот, который встречается реже (рецессивным чаще является мутантный аллель). Соответственно для определения доминантности или рецессивности необходимо знать популяционное распространение аллелей, но компании-производители реагентов при расшифровке результатов для удобства или обозначают аллели разным цветом, или указывают распространенность данного генотипа (в %, с пояснением о предрасположенности к снижению, повышению или нормальному проявлению признака).
Для наглядного примера можно посмотреть выдержку из отчета по результатам генетического тестирования (см. таблицу).

При оценке результатов тестирования (см. таблицу) видно, что ген COL1A1 не имеет генетического полиморфизма, а значит, отсутствует повышенный риск нарушения образования коллагена (по сравнению с популяционным риском). Ген ММР1 имеет генетический полиморфизм (рецессивная гомозигота), ген ММР3 также имеет генетический полиморфизм (гетерозигота), наличие подобных полиморфизмов ведет к риску снижения функции соответствующих ферментов (риск выше в случае рецессивной гомозиты). В целом при наличии подобных результатов предполагается, что у пациента дисбаланс по вероятным рискам нарушения процессов синтеза и деградации коллагена: при отсутствии риска изменения
синтеза коллагена повышен риск нарушения его деградации. Полученные результаты снижения вероятности быстрой деградации коллагеновых волокон являются показателем достаточного уровня поддержания механических свойств кожи для ответа на косметологические процедуры, направленные на улучшение качества кожи. Тогда как следствием повышенного риска нарушения деградации коллагена является формирование гипертрофических рубцов и фиброза после различных инвазивных процедур.
Генетический код и мутации
При репликации ДНК (создании дочерних ДНК-цепей) могут возникать ошибки в синтезе дочерней ДНК-мутации, которые могут влиять на фенотип, если затрагивают кодирующую область гена [30]. Ошибки происходят достаточно редко (1 на 10–100 млн пар оснований), исправлением большинства ошибок занимается фермент ДНК-полимераза [31, 32]. По сути мутации — это стойкие изменения генома, способные передаваться из поколения в поколение. При критическом
накоплении мутаций могут возникать раковые клетки, геном которых в сущности содержит историю мутагенных процессов [33]. Некоторые клетки рака могут содержать в себе тысячи мутаций [34].
Мутации бывают геномными (изменение количества хромосом), хромосомными (перестройка хромосом), генными, или точечными (изменение первичной структуры ДНК) [35, 36].
Мутации не всегда ассоциируются с возникновением отрицательных признаков, иногда они добавляют полезные признаки [37], такие мутации называются адаптационными. Более узким понятием мутаций представляется генетический полиморфизм.
Генетический полиморфизм
По сути генетический полиморфизм — это структурное изменение гена вследствие мутаций. По своему определению генетический полиморфизм — это менделевский признак, встречающийся в популяции, по крайней мере, в двух вариантах с частотой не менее 1% для каждого [38]. Отличие определения полиморфизма и мутации довольно условное и заключается в том, что генетический полиморфизм может встречаться более чем в 1% случаев у населения, а мутации — чаще менее 1%. Качественный генетический полиморфизм представлен преимущественно однонуклеотидными заменами (Single nucleotide polymorphism — SNP) — это отличие последовательности ДНК размером в один нуклеотид в геноме представителей одного вида или между участками гомологичных хромосом (рис. 11) [39]. Если при существовании 2 последовательностей ДНК они различаются на один нуклеотид, тогда говорят о существовании 2 аллелей.
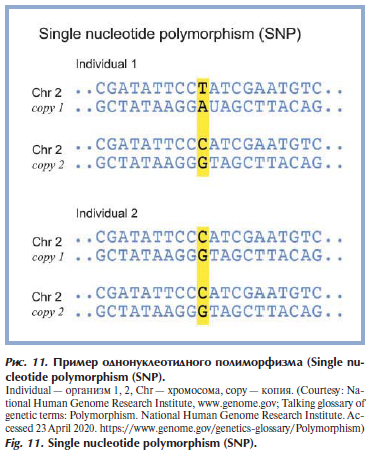
Классификация однонуклеотидных полиморфизмов такая же, как у точечных мутаций. Существуют различные базы данных SNP (однонуклеотидных полиморфизмов): dbSNP — база данных SNP, сводный общественный архив [40]; SNPedia — биоинформативный вики-сайт [41]; база данных GWAS (Genome Wide Association Studies — полногеномный скрининг ассоциаций [42, 43]; International HapMap Project — исследование карты гаплотипов человеческого генома [44]; MirSNP — база данных однонуклеотидных полиморфизмов, изменяющих сайты связывания микроРНК [45]. Общепринятое обозначение полиморфизмов — по референсному сиквенсу человека (Reference Sequence — Rs). Все Rs собраны в базу данных, и на основании этого определяются доминантные и рецессивные аллели.
Интерес к SNP значительно повысился после окончания полногеномного исследования, так как разнообразием ДНК объясняется различное течение заболеваний, различные реакции на патогены, лекарственные препараты и т.п. Наследуемые изменения генов определяют уникальный биохимический профиль каждого человека и играют решающую роль в наследственной предрасположенности к мультифакториальным заболеваниям. Исследования различных вариантов ДНК ведут к большему пониманию рисков, комплекса причин и методов лечения различных заболеваний [46].
Согласно различным исследованиям и данным медицинской генетики, наследственные болезни (напрямую связанные с мутациями) составляют только 1,5%. Большое количество остальных болезней появляется в результате сочетания неблагоприятных внешних факторов и особенностей генома [47], предрасполагающих к заболеванию, таким образом, реализуются мультифакториальные заболевания [48]. При этом гены, вовлеченные в генез мультифакториальных заболеваний, называются генами предрасположенности. Гены предрасположенности — это мутантные гены (аллели), которые совместимы с рождением и жизнью, но при определенных условиях способствуют развитию того или иного мультифакториального заболевания [49]. В развитие того или иного патологического процесса могут быть вовлечены разные группы генов. При этом сочетание различных аллельных вариантов генов в норме или вовлеченных в развитие
конкретной патологии получило название «генные сети», в которых выделяют главные (центральные) и дополнительные (вспомогательные) гены.
Для всех мульфакториальных заболеваний реализация генотипа в фенотип всегда имеет вероятный характер. В будущем планируется внедрить в практику автоматический расчет рисков на основе компьютерной программы [50]. Таким образом, при анализе результатов генетического тестирования и выявлении генетических полиморфизмов у пациентов с мультифакториальными заболеваниями мы говорим лишь о степени риска развития патологического процесса.
Заключение
Понимание и умение интерпретировать результаты генетических тестов имеют высокую диагностическую ценность в косметологии и дерматологии. Расшифровка результатов позволяет «предсказывать» возможные изменения состояния кожи, ответ на те или иные эстетические процедуры. В клинической практике возможно создание карты дерматологического (косметологического) пациента с указанием всех особенностей генотипа и фенотипа пациента. Такая карта будет сопровождать пациента в течение всей жизни при выборе рекомендаций по образу жизни, домашнему уходу, приему дополнительной нутритивной поддержки [51], проведению неинвазивных и инвазивных, в том числе эстетических,
процедур. При работе с результатами генетического тестирования необходим междисциплинарный подход врачей-дерматовенерологов, косметологов с врачами-генетиками для получения наиболее полного результата расшифровки теста.
Исследование проведено без спонсорской поддержки.
The study was performed without external funding.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.
ЛИТЕРАТУРА/REFERENCES
1. Alyass A, Turcotte M and Meyre D. From big data analysis to personalized medicine for all: challenges and opportunities. BMC Medical Genomics. 2015;8:33-45. https://doi.org/10.1186/s12920-015-0108-y
2. Семинский И.Ж. Медицинская генетика: основные понятия, методы, задачи (сообщение 1). Сибирский медицинский журнал. 2000;4:83-86. Seminsky IJ. The medical genetics: general conception, methods, problems (a report 1). Siberian Medical Journal. 2000;4:83-86. (In Russ.).
3. Панчин А.Ю. Сумма биотехнологии. Руководство по борьбе с мифами о генетической модификации растений, животных и людей. М.: АСТ:CORPUS; 2016. Panchin AJu. Summa biotehnologii. Rukovodstvo po bor’be s mifami o geneticheskoj
modifikacii rastenij, zhivotnyh i ljudej. M.: AST: CORPUS; 2016. (In Russ.).
4. Bustamante C, Bryant Z, Smith SB. Ten years of tension: single-molecule DNA mechanics. Nature. 2003;421(6921):423-427. https://doi.org/10.1038/nature01405
5. Talking glossary of genetic terms: Deoxyribonucleic Acid. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Deoxyribonucleic-Acid
6. Talking glossary of genetic terms: Cytosine. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Cytosine
7. Talking glossary of genetic terms: Guanine. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/guanine
8. Talking glossary of genetic terms: Chromatin. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Chromatin
9. Разин С.В., Быстрицкий А.А. Хроматин: упакованный геном. М.: БИНОМ: Лаборатория знаний; 2009. Razin SV, Bystritskii AA. Khromatin: upakovannyi genom. M.: BINOM: Laboratoriya znanii; 2009. (In Russ.).
10. Talking glossary of genetic terms: Messenger RNA. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/messenger-rna
11. Talking glossary of genetic terms: Transfer RNA. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Transfer-RNA
12. Nissen P, Hansen J, Ban N, Moore PB, Steitz TA. The structural basis of ribosome activity in peptide bond synthesis. Science. 2000;289(5481):920-930. https://doi.org/10.1126/science.289.5481.920
13. Higgs PG. RNA secondary structure: physical and computational aspects. Q Rev Biophys. 2000;33:199-253. https://doi.org/10.1017/s0033583500003620
14. Talking glossary of genetic terms: Protein. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Protein
15. Talking glossary of genetic terms: Genome. National Human Genome Research Institute. Accessed 18 April 2020. https://www.genome.gov/genetics-glossary/Genome
16. Talking glossary of genetic terms: Gene. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Gene
17. Bach C, Patra P. Human genome regulation. Bioengineered. 2016;7(2):57-59. https://doi.org/10.1080/21655979.2016.1142635
18. International Human Genome Sequencing Consortium. Finishing the euchromatic sequence of the human genome. Nature. 2004;409(6822):931-945. https://doi.org/10.1038/nature03001
19. International Human Genome Sequencing Consortium. Initial sequencing and analysis of the human genome. Nature. 2001;409(6822):860-921. https://doi.org/10.1038/35057062
20. Talking glossary of genetic terms: Codon. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Codon
21. Turanov AA, Lobanov AV, Fomenko DE, Morrison HG, Sogin ML, Klobutcher LA, Hatfield DL, Gladyshev VN. Genetic code supports targeted insertion of two amino acids by one codon. Science. 2009;323(5911): 259-261. https://doi.org/10.1126/science.1164748
22. Shu JJ. A new integrated symmetrical table for genetic codes. Biosystems. 2017;151:21-26. https://doi.org/10.1016/j.biosystems.2016.11.004
23. Nakamoto T. Evolution and the universality of the mechanism of initiation of protein synthesis. Gene. 2009;432(1-2):1-6. https://doi.org/10.1016/j.gene.2008.11.001
24. Maloy S. How nonsense mutations got their names. Microbial Genetics Course. San Diego State University. Accessed 18 April 2020. https://www.sci.sdsu.edu/~smaloy/MicrobialGenetics/topics/rev-sup/amber-name.html
25. Freeland SJ, Hurst LD. The genetic code is one in a million. J Mol Evol. 1998;47(3):238-248. https://doi.org/10.1007/pl00006381
26. Di Giulio M. The extension reached by the minimization of the polarity distances during the evolution of the genetic code. J Mol Evol. 1989;29(4):288-293. https://doi.org/10.1007/bf02103616
27. Wong JT. Role of minimization of chemical distances between amino acids in the evolution of the genetic code. Proc Natl Acad Sci USA. 1980;77(2): 1083-1086. https://doi.org/10.1073/pnas.77.2.1083
28. Горбунова В.Н. Медицинская генетика. Учебник для студентов медицинских вузов и слушателей последипломного образования. СПб.: СПбГПМУ; 2012. Gorbunova VN. Meditsinskaya genetika. Uchebnik dlya studentov meditsinskikh
vuzov i slushatelei poslediplomnogo obrazovaniya. SPb.: SPbGPMU; 2012. (In Russ.).
29. Talking glossary of genetic terms: Homozygous. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/homozygous
30. Sloan DB, Broz AK, Sharbrough J, Wu Z. Detecting Rare Mutations and DNA Damage with Sequencing-Based Methods. Trends Biotechnol. 2018; 36(7):729-740. https://doi.org/10.1016/j.tibtech.2018.02.009
31. Griffiths AJ, Miller JH, Suzuki DT, Lewontin RC, Gelbart WM. An Introduction to Genetic Analysis, 7th. New York: Freeman WH; 2000.
32. Freisinger E, Grollman AP, Miller H, Kisker C. Lesion (in)tolerance reveals insights into DNA replication fidelity. EMBO J. 2004;23(7):1494-1505. https://doi.org/10.1038/sj.emboj.7600158
33. Phillips DH. Mutational spectra and mutational signatures: Insights into cancer aetiology and mechanisms of DNA damage and repair. DNA Repair (Amst). 2018;71:6-11. https://doi.org/10.1016/j.dnarep.2018.08.003
34. Alexandrov LB, Nik-Zainal S, Wedge DC, Aparicio SA, Behjati S, Biankin AV, Bignell GR, Bolli N, Borg A, Børresen-Dale AL, Boyault S, Burkhardt B, Butler AP, Caldas C, Davies HR, Desmedt C, Eils R, Eyfjörd JE, Foekens JA, Greaves M, Hosoda F, Hutter B, Ilicic T, Imbeaud S, Imielinski M, Jäger N, Jones DT, Jones D, Knappskog S, Kool M, Lakhani SR, López-Otín C, Martin S, Munshi NC, Nakamura H, Northcott PA, Pajic M, Papaemmanuil E, Paradiso A, Pearson JV, Puente XS, Raine K, Ramakrishna M, Richardson AL, Richter J, Rosenstiel P, Schlesner M, Schumacher TN, Span PN, Teague JW, Totoki Y, Tutt AN, Valdés-Mas R, van Buuren MM, van ‘t Veer L, Vincent-Salomon A, Waddell N, Yates LR; Australian Pancreatic Cancer Genome Initiative; ICGC Breast Cancer Consortium; ICGC MMML-Seq Consortium; ICGC PedBrain, Zucman-Rossi J, Futreal PA, McDermott U, Lichter P, Meyerson M, Grimmond SM, Siebert R, Campo E, Shibata T, Pfister SM, Campbell PJ, Stratton MR. Signatures
of mutational processes in human cancer. Nature. 2013;500(7463): 415-421. https://doi.org/10.1038/nature12477
35. Richards S, Aziz N, Bale S, Bick D, Das S, Gastier-Foster J. Standards and Guidelines for the Interpretation of Sequence Variants: A Joint Consensus Recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med. 2015; 17(5):405-424. https://doi.org/10.1038/gim.2015.30
36. Isbrandt D, Hopwood JJ, von Figura K, Peters C. Two novel frameshift mutations causing premature stop codons in a patient with the severe form of Maroteaux-Lamy syndrome. Hum Mutat. 1996;7(4):361-363. https://doi.org/10.1002/(sici)1098-1004(1996)7:4<361::aid-humu12>3.0.co;2-0
37. Liu G, Liu X, Yu P, Wang Q, Wang H, Li C, Ye G, Wu X, Tan C. APOE gene polymorphism in long-lived individuals from a central China population. Sci Rep. 2017;3292(7):1-7. https://doi.org/10.1038/s41598-017-03227-5
38. Баранов В.С. Геномика на пути к предиктивной медицине. Acta Naturae. 2009;1(3):70-80. Baranov VS. Genome Paths A Way to Personalized and Predictive Medicine. Acta Naturae. 2009;1(3):70-80. (In Russ.). https://doi.org/10.32607/20758251-2009-1-3-70-80
39. Talking glossary of genetic terms: Polymorphism. National Human Genome Research Institute. Accessed 23 April 2020. https://www.genome.gov/genetics-glossary/Polymorphism
40. Wheeler DL, Barrett T, Benson DA, Bryant SH, Canese K, Chetvernin V, Church DM, DiCuccio M, Edgar R, Federhen S, Geer LY, Helmberg W, Kapustin Y, Kenton DL, Khovayko O, Lipman DJ, Madden TL, Maglott DR, Ostell J, Pruitt KD, Schuler GD, Schriml LM, Sequeira E, Sherry ST, Sirotkin K, Souvorov A, Starchenko G, Suzek TO, Tatusov R, Tatusova TA, Wagner L, Yaschenko E. Database resources of the National Center for Biotechnology Information. Nucleic Acids Res. 2006;34(1):173-180.
https://doi.org/10.1093/nar/gkj158
41. Cariaso M, Lennon G. SNPedia: a wiki supporting personal genome annotation, interpretation and analysis. Nucleic Acids Res. 2012;40(D1):1308-1312. https://doi.org/10.1093/nar/gkr798
42. GWAS central. Accessed 18 April 2020. https://www.gwascentral.org/
43. White MJ, Yaspan BL, Veatch OJ, Goddard P, Risse-Adams OS, Contreras MG. Strategies for Pathway Analysis Using GWAS and WGS Data. Curr Protoc Hum Genet. 2019;100(1):e79. https://doi.org/10.1002/cphg.79
44. Nowakowska B. Clinical interpretation of copy number variants in the human genome. J Appl Genet. 2017;58(4):449-457. https://doi.org/10.1007/s13353-017-0407-4
45. Liu C, Zhang F, Li T, Lu M, Wang L, Yue W, Zhang D. MirSNP, a database of polymorphisms altering miRNA target sites, identifies miRNA-related SNPs in GWAS SNPs and eQTLs. BMC Genomics. 2012;13:661.
46. Apellaniz-Ruiza M, Gallegoa C, Ruiz-Pintoa S, Carracedo A, Rodríguez-Antona C. Human genetics: international projects and personalized medicine. Drug Metabol Pers Ther. 2016;31(1):3-8. https://doi.org/10.1515/dmpt-2015-0032
47. Пузырев В.П. Вольности генома и медицинская патогенетика. Бюллетень сибирской медицины. 2002;2:16-29. Puzyryov VP. Liberties of genome and medical pathogenetics. Byulleten’ sibirskoi meditsiny. 2002;2:16-29. (In Russ.).
48. Artells R, Pruna R, Dellal A, Maffulli N. Elastin: a possible genetic biomarker for more severe ligament injuries in elite soccer. A pilot study. Muscles, Ligaments and Tendons Journal. 2016;6(2):188-192. https://doi.org/10.11138/mltj/2016.6.2.188
49. Баранов В.С., Баранова Е.В. Геном человека, эпигенетика многофакторных болезней и персонифицированная медицина. Биосфера. 2012; 4(1):76-85. Baranov VS, Baranova EV. Human genome, epigenetics of complex diseases and personalized medicine. Biosphera. 2012;4(1):76-85 (In Russ.).
50. Grapov D, Fahrmann J, Wanichthanarak K, Khoomrung S. Rise of Deep Learning for Genomic, Proteomic, and Metabolomic Data Integration in Precision Medicine. OMICS. 2018;22(10):630-636. https://doi.org/10.1089/omi.2018.0097
51. Carlberg C. Nutrigenomics of Vitamin D. Nutrients. 2019;11:676-691. https://doi.org/10.3390/nu11030676
