Бычкова Наталья Юрьевна, к.м.н., косметолог, врач-дерматолог высшей категории, доцент кафедры эстетической медицины ФГАОУ ВО «Российский университет дружбы народов», член профильной комиссии по дерматовенерологии и косметологии МЗ РФ, главный внештатный специалист по косметологии МЗ УР, президент Ассоциации «Секция эстетической медицины», председатель Экспертного совета по лечению осложнений в косметологии, Москва
Наумова Наталья Георгиевна, к.м.н., доцент, заведующая кафедрой биохимии ФГБОУ ВО ИГМА МЗ РФ, Ижевск
Забота о сохранении структуры и ресурсов кожи – актуальная парадигма современной косметологии. Наблюдаемые при старении изменения кожного рельефа являются отражением сложных структурных деформаций, которые происходят в многослойном, морфологически неоднородном органе, содержащем ткани с сильно отличающимися механическими и функциональными характеристиками – в собственно дерме, подкожной клетчатке и SMAS. Адекватная превенция с применением современных эффективных многовекторных инъекционных протоколов способна замедлить прогрессирование возраст-ассоциированных изменений.
Гомеостаз внеклеточного матрикса
Оптимальный уровень биосинтеза коллагенов и других фибриллярных компонентов внеклеточного матрикса является одним из важнейших показателей нормофизиологического метаболизма дермы [2]. Фибриллярный каркас кожи человека образован соединенными между собой фибриллами, фибриллярными пучками и волокнами. Они образуют трехмерный сетчатый, или пространственный, каркас, подразделяющийся на три основных типа (слоеобразующий, ромбический и
сложно-петельный). Каждый паттерн имеет свою определенную топографоанатомическую локализацию и зависит от испытываемой механической нагрузки [21]. Коллагены – наиболее распространенные фибриллярные белки внеклеточного матрикса соединительной ткани. Появление коллагенов позволило создать скелет, как внешний, так и внутренний, и резко увеличить размеры организма. Синтез фибриллярных белков – энергозатратный процесс и происходит только у животных, которые используют кислород. В настоящее время у человека описано порядка 30 типов коллагеновых волокон, в коже определяют 9 типов: 1) волокна, которые формируют каркас дермы; 2) гибкие волокна, которые придают
ткани эластичность; 3) сетчатые волокна, которые образуют перекрестные связи между всеми другими волокнами и соединяют все остальные компоненты ткани. Наиболее распространенным дермальным белком является коллаген I типа. Он представлен плотно упакованными толстыми волокнами, и основной его функцией является препятствие растяжению. Коллаген II типа образует рыхлую сеть коллагеновых волокон, его главная функция – сохранение устойчивости кожи к перепадам давления. Коллаген III типа образует рыхлую сеть тонких волокон, функция которых – поддержка структуры и стабильности стенки сосудов, поскольку мутации генов, кодирующих эти молекулы, приводят к разрывам сосудов в процессе эмбрионального развития [14]. Коллаген IV типа составляет основную часть базальной мембраны эпидермодермальной зоны, сосудов и придатков кожи. Коллаген V типа располагается преимущественно в сосочковом слое дермы и вокруг базальных мембран сосудов, нервов и придаточных образований кожи, а также в пограничной эпидермодермальной зоне. Коллаген VI типа пронизывает всю дерму в виде сети. Коллаген VII типа формирует прикрепляющие фибриллы сосочкового слоя дермы. Коллаген VIII типа является главным компонентом десцеметовых мембран и эндотелия. Коллагены IX и XII типов являются фибрилл-связывающими коллагенами, эти коллагены прикрепляются к поверхности фибрилл на определенном расстоянии друг от друга и взаимодействуют как с фибриллами, так и с другими компонентами межклеточного матрикса; эти соединения делают структуру коллагенов более прочной. Помимо коллагенов в межклеточном матриксе располагаются и другие белковые молекулы [2, 13].
Межклеточный коллоидный матрикс содержит определенное количество свободной воды, не связанной с протеогликанами основного вещества дермы [1, 3]. В зависимости от степени полимеризации протеогликанов количество свободной воды в интерстиции существенно колеблется. Межклеточный матрикс имеет неодинаковую плотность и разное содержание свободной воды, образуя между пучками коллагеновых волокон тканевые щели, не имеющие эндотелиальной
стенки, однако способные транспортировать тканевую жидкость (рис. 1).

Эти пути несосудистой интерстициальной микроциркуляции M. Foldi и G. Casley-Smith назвали прелимфатиками (prelympatiсs) [1]. Волоконный аппарат дермы также представляет собой неоднородную структуру, содержащую окситалановые волокна, тропоколлаген, эсластиновую и ретикулиновую сети, коллагеновые волокна третьего и четвертого порядка, retinaculum cutis. В наибольшей степени выраженность нарушений его архитектоники наблюдается в местах пересечения вектороd (тензоров) динамических сил, воздействующих на кожу [2].
Межклеточный матрикс и клетки дермы находятся в непрерывном взаимодействии, оказывая друг на друга взаимное влияние, формируя сложную многокомпонентную «экологическую систему». Но свойства кожи обусловлены не только клеточным составом и межклеточными взаимодействиями, они определяются пространственной архитектоникой соединительнотканных волокон. В настоящее время считается доказанным, что волокна дермы не хаотично переплетены, а представляют структурированную сеть с ячейками в виде ромбов [8]. Большая часть волокон находится в ненатянутом и скрученном состоянии, а натяжение ведет к их распутыванию и выпрямлению. При старении эти процессы нарушаются, фибрилляные дермальные структуры утрачивают четкую организацию, позднее присоединяются микроциркуляторные, гипоксические, обменные нарушения, нарушаются синтетические процессы. С позиций функциональной гистоархитектоники органы, являющиеся сложноорганизованными структурами, состоят из структурно-функциональных единиц. В качестве подобной структуры в дерме выделяют «лимфатический регион», который включает рыхлую соединительную ткань с путями внесосудистой циркуляции (интерстиций), кровеносное и лимфатическое русла [1]. Интракорпоральное кровообращение преимущественно обеспечивают кровь, лимфа и тканевая жидкость (водная фракция межклеточного гелеобразного матрикса). Другие биологические жидкости являются дериватами этих главных участников интракорпорального кругооборота воды.
Механические свойства кожи
Установлено [5, 15, 18], что кожа обладает различными биофизическими (анизотропными) свойствами, претерпевает постоянные изменения за счет процессов роста, старения и протекающих в организме патологических процессов, растягивается и удлиняется, испытывая большие деформации. Впервые анизотропия ((от др.-греч. ἄνισος – неравный и τρόπος – направление) – различие механических свойств в различных направлениях из-за естественного натяжения кожи.) кожи была описана в работе Карла Лангера в 1861 г. [15]. Процессы старения развиваются не синхронно, характерна их гетерохрония ((от греч. ἕτερος – различный и χρόνος – время) – несовпадение во времени фаз развития отдельных органов и структурных образований.): в зонах сверхкритических деформаций возраст-ассоциированные изменения происходят более интенсивно (периоральная и периорбитальные области, лоб, межбровье, височная область,
щеки, передняя поверхность шеи). Они являются максимально выраженными в участках с большей динамической нагрузкой, где раньше наблюдаются структурные нарушения архитектоники волокон дермы, которые нередко сопровождаются микроциркуляторными нарушениями. Локализация этих зон не всегда совпадает с направлением морщин и в ряде случаев предшествует их появлению. Многочисленные исследования в самых разных областях медицины показали, что анизотропия кожи является объективным диагностическим критерием и может использоваться для диагностики структурных нарушений дермы. Величина критической динамической нагрузки зависит от эластичности тканей, прочности на растяжение и изгиб, адгезии между слоями, относительной толщины слоев, способностью преобразовывать механическую энергию в энергию изгиба/деформации (рис. 2).
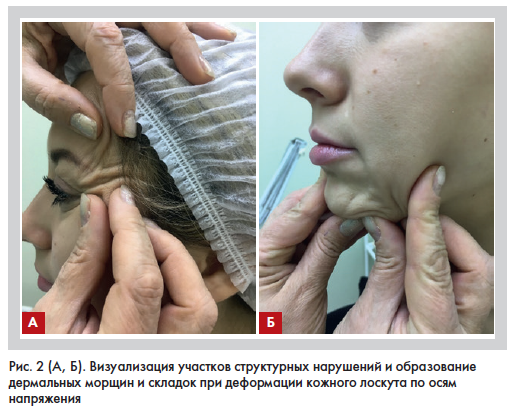
В случае выраженной дезорганизации опорных фибриллярных структур и атрофии подкожной клетчатки, которая компенсирует эти напряжения, морщины будут образовываться быстрее. Величина критической динамической нагрузки зависит от эластичности тканей, прочности на растяжение и изгиб, адгезии между слоями, относительной толщины слоев [2, 3, 17, 22].
Эпидермальная дисфункция, снижение эластичности дермы, атрофия и дислокация жировых компартментов в сочетании с дисфункцией мышц и потерей объема подлежащих костных структур приводят к морщинам, нарушениям конфигурации и «дряблому виду» кожи лица [12]. Для повышения эффективности эстетической коррекции важны знания патофизиологии старения, понимание этапности процессов коррекции, включающих мышечный контроль, восстановление объема и реконтурирование, а также компенсацию дисфункциональных метаболических дермальных нарушений [9, 20].
Персонифицированный подход к коррекции возрастассоциированных изменений
Целесообразно применение препаратов, позволяющих воздействовать на основные патогенетические механизмы развития возрастных изменений: дезорганизация дермальных структур, нарушения микроциркуляции, митохондриальная дисфункция, снижение синтеза и пролиферации, дисметаболические нарушения.
Большое значение в комплексных протоколах коррекции возрастных изменений будут играть препараты метаболического типа действия, содержащие полимолочную кислоту. Полимолочная кислота (полилактид, PLA) представляет собой синтезируемый биоразлагаемый биосовместимый полимер, мономером которого является молочная кислота. Сегодня PLA одобрена FDA и европейскими регулирующими органами для использования в системах доставки продуктов питания
и лекарств [16].
Важной особенностью PLA является безопасность и прогнозируемая биодеградация в биологических тканях. В косметологии инъекционные имплантаты на основе L-формы полилактида (PLLA) применяются около 20 лет, и в настоящее время накоплен большой опыт эффективного и безопасного их использования. Инъекционная поли-D,L-молочная кислота (PDLLA) – новый наполнитель, получивший распространение в последние годы.
По сравнению с традиционными дермальными наполнителями (филлерами) имплантаты на основе полимолочной кислоты обладают эффектом биологической стимуляции, усиливая синтез эндогенного коллагена и активизируя работу дермальных фибробластов после инъекции. Стимулирующее влияние PLA является выраженным и сохраняется в течение двух и более лет.
В современной физиологии лактат больше не рассматривается как тупиковый метаболит, агент усталости или метаболический яд. Напротив, он рассматривается как основной метаболический продукт, который оказывает широкое влияние на использование энергетического субстрата, передачу сигналов клетками и адаптацию. Значение переноса лактата признано в таких областях, как заживление ран, биология рака, секреция инсулина, обучение и память и других физиологических процессах, являясь точкой опоры метаболической интеграции [10]. Молочная кислота является энергетическим субстратом и оказывает влияние на метаболическую функцию клеток. Из-за своего небольшого размера
она может проникать через липидную мембрану клеток посредством челночной системы белков-транспортеров монокарбоксилатов, или «лактатных челноков». Последние исследования показывают, что лактат является ключевым компонентом обменных процессов, он образуется и непрерывно используется в различных клетках [10, 11, 19]. Концепции «клетка-клетка» и «внутриклеточный лактатный челнок» описывают роль лактата в доставке окислительных и глюконеогенных субстратов, а также в передаче клеточных сигналов. Также было показано, что LA обладает антиоксидантными свойствами, которые могут служить для защиты клеток от повреждения, вызванного свободными радикалами. Оказывая влияние на регуляцию окислительно-восстановительного потенциала клеток, аллостерическое связывание и перепрограммирование хроматина путем лактилирования остатков лизина на гистонах, лактат играет большую роль в распределении энергии в клетках, выполняя метаболические (окислительное топливо, экспрессия гликолитических и метаболических ферментов), регуляторные (воздействие на окислительно-восстановительный потенциал клеток, выработку АФК, лактилирование и ковалентное связывание) и сигнальные функции (метаболическая сигнализация, включающая изменение L/P и NADH/NAD+ и изменяющая окислительно-восстановительный потенциал клеток; активация сиртуинов через фермент NAM фосфорибозилтрансферазу (Nampt); регулирование секреции трансформирующего фактора роста бета 2 (TGF-β2), активация рецептора гидроксикарбоновой кислоты-1 (HCAR-1), действующего через циклический АМФ (цАМФ), и связывание ответного элемента цАМФ) [11]. Лактат является основным метаболическим субстратом разветвленной сети митохондриального ретикулума, который простирается от субсарколемного домена до глубоких волокон, представляя собой «энергетическую магистраль». Для окисления энергетических продуктов гликолиза ретикулум содержит переносчики лактата (mMCT) и пирувата (mPC). Важно отметить, что, поскольку продуктом гликолиза является лактат,
а не пируват, митохондриальное поглощение и окисление намного превышают таковые для пирувата. Недавние исследования привели к открытию митохондриального комплекса окисления лактата (mLOC) in vivo.
Общеизвестно, что в нашем организме обмену подвергаются углеводы D-ряда [7]. Так, D-глюкоза участвует в энергетическом обмене, а именно в анаэробном гликолизе до молочной кислоты и аэробном распаде до углекислого газа и воды. При этом D-глюкоза, которая является гексозой, образует две триозы (пируват), из которого при анаэробном гликолизе образуется лактат (или молочная кислота) также D-ряда. Лактат далее может использоваться в процессах глюконеогенеза – синтеза новой молекулы глюкозы – или через пируват превращаться в ацетил-коэнзим А, который окисляется в цикле трикарбоновых кислот до углекислого газа и воды с выделением энергии [4].
Таким образом, фармакотерапевтические эффекты препаратов PLA направлены на восстановление и регуляцию биохимических реакций, нарушенных патологическими процессами, и обеспечивают митохондриально-протекторную поддержку, необходимую для адекватного синтеза структурных компонентов дермы/
Учитывая индивидуальную анатомическую вариативность, сложную структурную организацию, разность механических свойств различных слоев кожи, усугубляющихся с возрастом, раннее появление возрастных изменений в местах пересечения векторов (тензоров) динамических сил, учет анизотропных свойств кожи позволяет проводить терапию именно тех участков, где возрастные изменения выражены максимально. Существуют разные способы оценки динамических свойств кожи в зависимости от направления воздействия из-за естественного натяжения кожи и степени выраженности возрастных изменений. Нами использовался метод пальпации для выявления областей максимально выраженных структурных нарушений дермы (областях максимальной дезорганизации – ОМД). Предложенная нами методика (патент на изобретение № 2735816 от 09.11.2020) предлагает доступный способ оценки биомеханических (анизотропных) свойств кожи путем определения силовых линий при помощи пальпации.
Этот метод позволяет решать практические задачи по распределению напряжений в коже и определять участки, где возрастные изменения выражены максимально, что позволяет проводить персонифицированную терапию с учетом выявленных индивидуальных особенностей, повышая адгезию между слоями дермы и подкожной клетчатки, уменьшая внешние проявления старения, способствуя улучшению вязко-эластических свойств кожи и нормализации микроциркуляции, что клинически проявляется разглаживанием морщин и уменьшением пастозности и проявлений гравитационного птоза.
Препарат выбора
Компания «Ингал» разработала собственную уникальную технологию [6] двойной лиофилизации для производства препарата на основе поли-D,L-молочной кислоты III поколения Repart® PLA, позволяющую получить микрочастицы со стандартизированным размером, имеющие правильную сферическую форму с гладкой поверхностью (рис. 3).
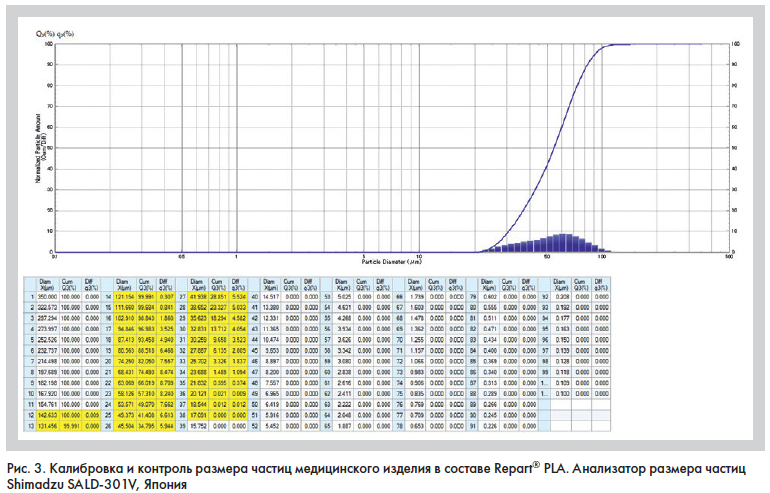
Технологический процесс производства препарата Repart® PLA включает несколько этапов: эмульгирование субстанции PLA, созревание микросфер с заданными гранулометрическими параметрами, двойная лиофилизация с получением сухой пористой массы и стерилизация радиоактивным методом.
Таким образом, благодаря разработке и внедрению новой технологии двойной лиофилизации удалось создать эффективный продукт III поколения Repart® PLA со следующими важными характеристиками.
Для специалиста:
– время приготовления рабочей суспензии сокращено до 3 минут;
– идеальная сферичная форма микрочастиц PLA обусловливает равномерное распределение в тканях;
– иглы и канюли не закупориваются в процессе работы.
Для пациента:
– высокая комфортность процедуры, нет отеков и болезненности;
– отсутствие необходимости в проведении массажа после имплантации;
– результат наблюдается в течение первого месяца после имплантации и сохраняется до 2 лет.
Показания к применению
Показаниями к применению препарата Repart® PLA являются мимические и статические морщины различной степени выраженности, ухудшение рельефа кожи, увеличение и/или восстановление объема мягких тканей лица (щечно-скуловой и височной областей, нижней трети), коррекция возрастных изменений и создание дополнительного объема кожи и подкожной клетчатки кистей рук.
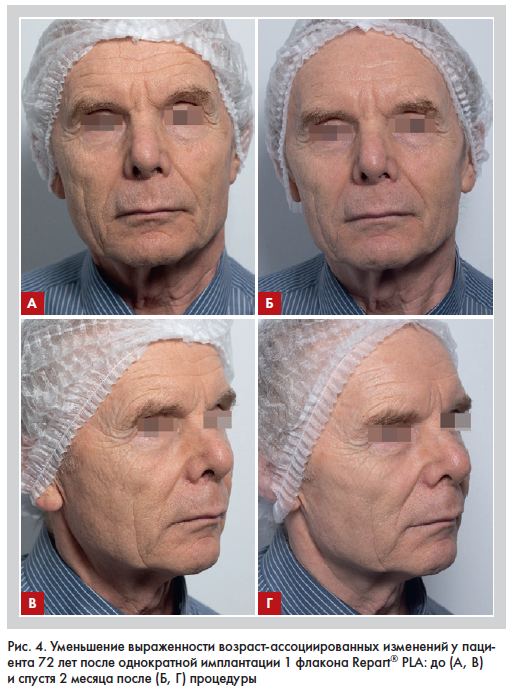
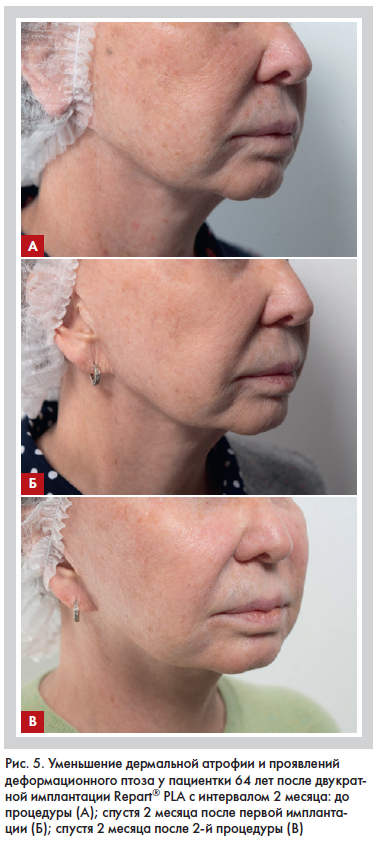
Благодаря комплексному патогенетическому таргетному воздействию на ряд дисфункциональных изменений, наблюдаемых при старении, применение препарата полимолочной кислоты III генерации, содержащего уникальную комбинацию D и L форм PLA, демонстрирует значительное клиническое улучшение и минимизацию внешних проявлений старения у пациентов разных возрастных групп, в том числе у пациентов старшего возраста (рис. 4, 5).
И в заключение
1. Предложенный метод позволяет решать практические задачи по коррекции признаков старения кожи с учетом ее механических (анизотропных) свойств и определять участки, где возрастные изменения выражены максимально, что
позволяет проводить эффективную персонифицированную терапию.
2. Разработанная и запатентованная медицинская технология производства препарата Repart® PLA, содержащего уникальную комбинацию D и L форм полимолочной кислоты, позволяет осуществлять патогенетическое комплексное таргетное воздействие на ряд дисфункциональных изменений, наблюдаемых при старении.
3. Применение препарата полимолочной кислоты III генерации (Repart® PLA) демонстрирует значительное клиническое улучшение и минимизацию внешних проявлений старения у пациентов разных возрастных групп, в том числе
у пациентов старшего возраста.
ЛИТЕРАТУРА
[1] Бородин Ю.И. Лимфатическая система и старение // Фундаментальные исследования. – 2011. – № 5. – С. 11–15.
[2] Бычкова Н.Ю., Воронцова Т.С. Значение патологии соединительной ткани при проведении инвазивных процедур и манипуляций // Эстетическая медицина. – 2020. – Т. XIX, № 2. – С. 152–161.
[3] Гайдаш А.А., Чигодайкин Г.П., Карачёва Ю.В. и др. Структура межклеточного матрикса кожи различных соматотипов человека по данным атомно-силовой микроскопии // Сиб. мед. журн. – 2011. – № 5. – С. 34–38.
[4] Биологическая химия: учебник / А.И. Глухов, С.Е. Северин, Т.Л. Алейникова, С.А. Силаева. – 4-е изд., испр. и доп. – М.: Медицинское информационное агентство, 2023. – 504 с.: ил. ISBN 978-5-9986-0505-5.
[5] Кругликов И. Старение кожи как механический феномен: основные слабые звенья стареющей кожи // Эстетическая медицина. – 2018. – Т. XVII, № 4. – С. 392–399.
[6] Первых С.Л. Российское медицинское производство: надежда на себя – основание храбрости // Метаморфозы. – 2023. – № 41. – С. 3–4.
[7] Покровский В.С. Биохимия человека. Обмен углеводов: учебное пособие. – М.:Е-ното, 2022. – 360 с. ISBN 978-5-906023-32-2.
[8] Федоров А.Е., Самарцев В.А., Кириллова Т.А. О механических свойствах кожи человека // Российский журнал биомеханики. – 2006. – Т. 10, № 2. – С. 29–42.
[9] Akinbiyi T., Othman S., Familusi O., Calvert C., Card E.B., Percec I. Better Results in Facial Rejuvenation with Fillers. Plast Reconstr Surg Glob Open. 2020 Oct 15; 8(10): e2763. doi: 10.1097/GOX.0000000000002763. PMID: 33173655; PMCID: PMC7647625.
[10] Brooks G.A., Arevalo J.A., Osmond A.D., Leija R.G., Curl C.C., Tovar A.P. Lactate in contemporary biology: a phoenix risen. J Physiol. 2022 Mar; 600(5): 1229–1251. doi: 10.1113/JP280955. Epub 2021 Feb 25. PMID: 33566386; PMCID: PMC9188361.
[11] Brooks G.A., Curl C.C., Leija R.G., Osmond A.D., Duong J.J., Arevalo J.A. Tracing the lactate shuttle to the mitochondrial reticulum. Exp Mol Med. 2022 Sep; 54(9): 1332–1347. doi: 10.1038/s12276-022-00802-3. Epub 2022 Sep 8. PMID: 36075947;
PMCID: PMC9534995.
[12] Cotofana S., Fratila A.A.M., Schenck T.L., Redka-Swoboda W., Zilinsky I. Pavicic Т. / The Anatomy of the Aging Face: A Review. Facial Plast Surg. 2016 Jun; 32(3): 253–260. doi: 10.1055/s-0036-1582234. Epub 2016 Jun 1. PMID: 27248022.
[13] Järveläinen H., Sainio A., Koulu M. et al. Extracellular matrix molecules: potential targets in pharmacotherapy. Pharmacol Rev 2009; 61 (2): 198–223.
[14] Kuivaniemi H., Tromp G. Type III collagen (COL3A1): Gene and protein structure, tissue distribution, and associated diseases. Gene. 2019 Jul 30; 707: 151–171. doi: 10.1016/j.gene.2019.05.003. Epub 2019 May 7. PMID: 31075413; PMCID:
PMC6579750.
[15] Langer K. On the anatomy and physiology of the skin. The Imperial Academy of Science, Vienna. Reprinted in (1978): British Journal of Plastic Surgery, 1861. 17(31): p. 93–106.
[16] Li G., Zhao M., Xu F., Yang B., Li X., Meng X., Teng L., Sun F., Li Y. Synthesis and Biological Application of Polylactic Acid. Molecules. 2020 Oct 29; 25(21): 5023. doi: 10.3390/molecules25215023. PMID: 33138232; PMCID: PMC7662581.
[17] Kang M.J., Kim B.-S., Hwang S., Yoo H.H. Experimentally derived viscoelastic properties of human skin and muscle in vitro/ Med Eng Phys. 2018 Nov; 61: 25–31. doi: 10.1016/j.medengphy.2018.08.001. Epub 2018 Aug 18. PMID: 30131279.
[18] Ni Annaidh A., et al. Tension’Lines’of’the’Skin, Skin Biophysics, Studies in Mechanobiology, Tissue Engineering and Biomaterials 22, 2019. p. 265–280.
[19] Poole D.C., Rossiter H.B., Brooks G.A., Gladden L.B. The anaerobic threshold: 50+ years of controversy. J Physiol. 2021 Feb; 599(3): 737–767. doi: 10.1113/JP279963. Epub 2020 Nov 19. PMID: 33112439.
[20] Sundaram H., Signorini M., Liew S., Trindade de Almeida A.R., Wu Y., Vieira Braz A., Fagien S., Goodman G.J., Monheit G., Raspaldo H. Global Aesthetics Consensus Group. Global Aesthetics Consensus: Botulinum Toxin Type A – Evidence-Based Review, Emerging Concepts, and Consensus Recommendations for Aesthetic Use, Including Updates on Complications. Plast Reconstr Surg. 2016 Mar; 137(3): 518e–529e. doi: 10.1097/01.prs.0000475758.63709.23. PMID: 26910696; PMCID: PMC5242214.
[21] Vinogradova E.V., Mikhaĭlov I.N. Regional’nye osobennosti arkhitektoniki voloknistogo karkasa dermy kozhi cheloveka [Regional features of the architectonics of the dermal fibrous framework of human skin]. Arkh Anat Gistol Embriol. 1978 Sep; 75(9):
91–97. Russian. PMID: 718439.
[22] Wong R., Geyer S., Weninger W., Guimberteau J.C., Wong J.K. The dynamic anatomy and patterning of skin. Exp Dermatol. 2016 Feb; 25(2): 92–8. doi: 10.1111/exd.12832. Epub 2015 Oct 13. PMID: 26284579.

