Автор: Романова Светлана Борисовна, врач-косметолог, врач-дерматовенеролог
Рубцовая ткань образуется в виде физиологического ответа на повреждение кожных покровов и слизистых оболочек после травм, воспалений и хирургических вмешательств. Однако дисбаланс между разрушением и синтезом коллагена приводит к чрезмерному рубцеванию и образованию келоидных и гипертрофических рубцов.
В развитии гипертрофических рубцов основную роль играет нарушение метаболизма внеклеточного матрикса вновь синтезированной соединительной ткани: гиперпродукция и нарушение процессов ремоделирования межклеточного матрикса с повышенной экспрессией коллагена I и III типов1. Рубцовая ткань отличается от тканей, которые она замещает, пониженными функциональными свойствами2.
В этой связи мною были выбраны максимально эффективные методы воздействия на измененный коллаген3.
Безусловно, в практике врача-косметолога наилучшие результаты в коррекции любой проблемы достигаются только в комплексе применения нескольких методик4.
В этой связи мне хотелось бы поделиться ярким положительным результатом лечения послеоперационных рубцов в области заушного пространства.
Клинический случай
Женщина, 44 года, поступила на амбулаторный прием через 3 месяца после проведенной операции по поводу хирургического лифтинга средней и нижней трети лица.
St. localis: грубый гипертрофический рубец, высокой плотности, размером 4,0/1,0 см, около 0,6 см с возвышающимся валиком над поверхностью кожи. Усиление сосудистого рисунка в зоне нижнего квадрата 5,0/5,0 см от козелка до угла нижней челюсти. 1–2 фототип по Фитцпатрику. Комбинированная кожа. Распространенные и яркие эфелиды в области носа и скул.
Хронических заболеваний, аллергических реакций, гепатита, туберкулеза, ВИЧ инфицирования, гемотрансфузий не наблюдалось.
Предварительно мы провели с пациентом пять процедур магнитотерапии и фотобиомодуляции, кратностью 2 раза в неделю. Затем провели одну сессию RF-фракционного лифтинга и инъекцию коллагенстимулирующего препарата с промежутком 3 недели между процедурами. В целом лечение заняло 6 недель.
Протокол процедур
Магнитотерапия проводилась на параметрах: power: 3, время – 10 минут, на курс № 5.
Фотобиомодуляция проводилась сразу после магнитотерапии на спектре лучей Green и White, в режиме Medium по 7 минут, на курс № 5.
Фракционный RF-лифтинг проводился через неделю после предыдущих процедур однократно, на режимах 280 v, 10 ms, 35 % покрытия, затем 250 v, 28 ms, 80 % покрытия.
Коллагеностимулятор был введен в зону рубцовой ткани через 2 недели после фракционного RF-лифтинга, однократно.
Результат
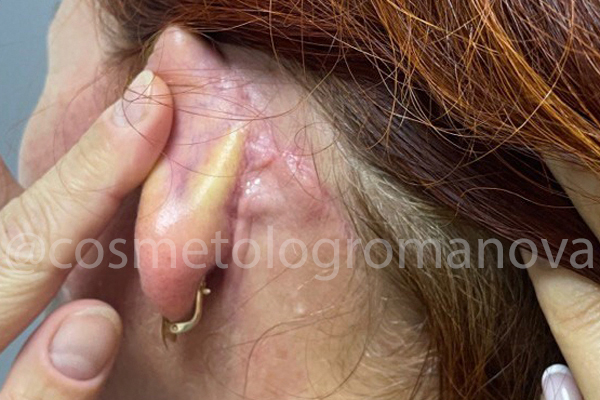
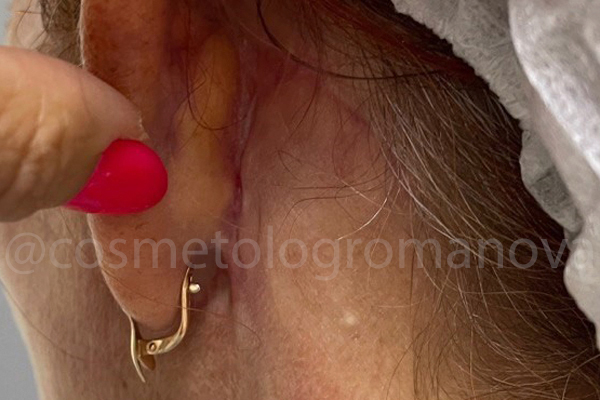
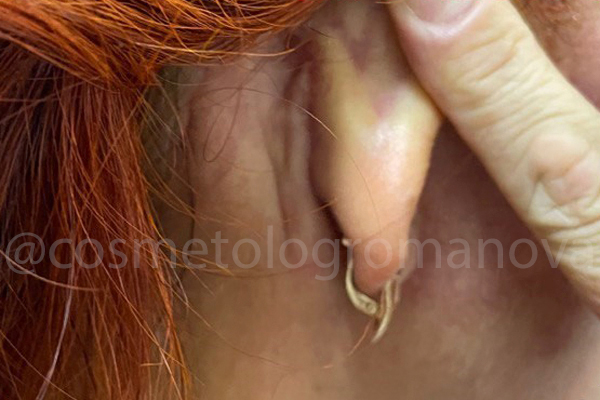
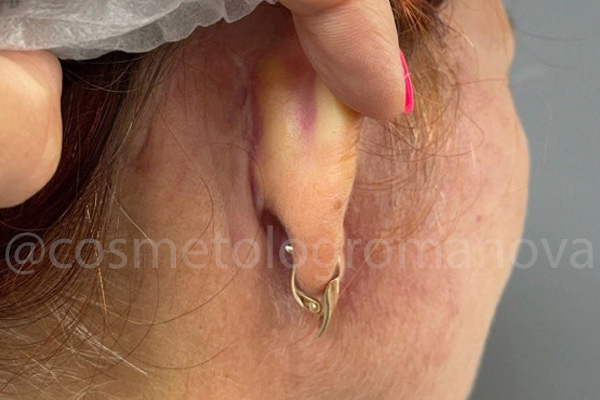
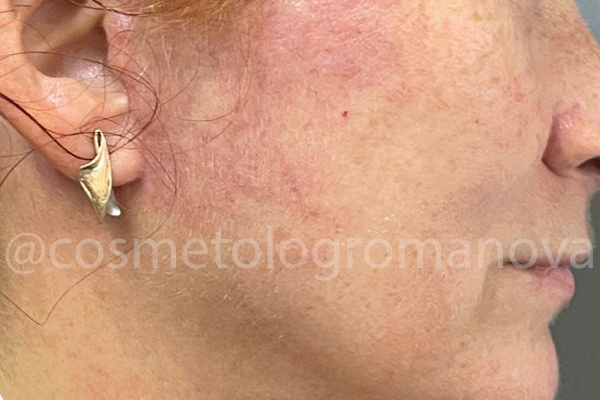
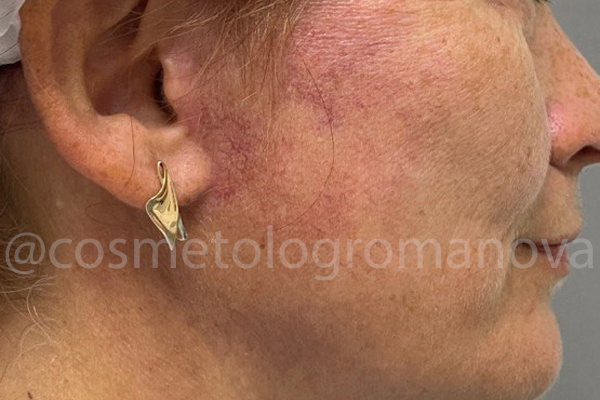
Результат очевиден, зафиксирован спустя 3 недели после проведения всех процедур.
St. localis: нормотрофический рубец, малой плотности, размером 4,0/0,1см. Явное ослабление сосудистого рисунка в зоне нижнего квадрата 5,0/5,0 см от козелка до угла нижней челюсти.
Выводы
- Эффективность комбинированной терапии RF-фракционным лифтингом в сочетании с коллагенстимулирующим препаратом оказалась высокой даже при однократном применении.
- Подготовка кожи магнитотерапией и фотобиомодуляцией также способствовала получению максимально эффективных результатов.
- Чистота эксперимента подтверждается отсутствием каких-либо других действий со стороны пациента.
Источники:
- Клименкова НВ., Шиманская ИГ. Современные подходы к лечению акне и постакне // Международные обзоры: клиническая практика и здоровье. 2017. №3.
- Филиппова ОВ, Афоничев КА, Красногорский ИН, Вашетко РВ. Клинико-морфологические особенности сосудистого русла гипертрофической рубцовой ткани в разные сроки ее формирования // Ортопедия, травматология и восстановительная хирургия детского возраста. 2017. №3; van der Veen WM, Bloemen MC, Ulrich MM, Molema G, van Zuijlen PP, Middelkoop E, et al. Potential cellular and molecular causes of hypertrophic scar formation. Burns 2009;35(1):15–29.
- Armour A, Scott PG, Tredget EE. Cellular and molecular pathology of HTS: basis for treatment. Wound Repair Regen 2007;15(Suppl. 1):S6–17; Fujiwara M, Muragaki Y, Ooshima A. Upregulation of transforming growth factor-beta1 and vascular endothelial growth factor in cultured keloid fibroblasts: relevance to angiogenic activity. Arch Dermatol Res 2005; 297: 161–9.
- Mustoe TA, Cooter RD, Gold MH, Hobbs FD, et al. International clinical recommendations on scar management. Plast Reconstr Surg 2002;110:560–71.
