Автор:

По данным Международного общества эстетической и пластической хирургии (ISAPS), в период с 2016 по 2020 год число нехирургических процедур с применением полимолочной кислоты увеличилось на 52 % 1. Судя по всему, такая тенденция будет сохраняться и дальше. Наиболее вероятными причинами роста стали как большой накопленный опыт безопасного применения полимолочной кислоты, так и появление новых препаратов и фармацевтических форм.
Полимолочная кислота представляет собой биосовместимый, биодеградируемый и полностью элиминирующийся из организма синтетический полимер из группы альфа-оксикислот. Важным свойством полилактида является биостимулирующее действие на соединительную ткань человеческого организма, реализующееся через разные биологические механизмы. В отношении кожи и подкожной клетчатки полимолочная кислота вызывает стимуляцию синтеза эндогенного коллагена I и III типов.
Полимолочная кислота (PLA) уже давно используется в качестве имплантатов и рассасывающегося шовного материала. Она была одобрена в Европе в 1999 году в качестве суспензии для увеличения определенных областей лица, лечения шрамов и морщин, а также лечения ВИЧ-ассоциированной лицевой липодистрофии в США в 2005 году 2. Сегодня мы наблюдаем более широкое использование этого полимера не только в медицине, но и в промышленности. В медицинской практике PLA представляет особый интерес в травматологии и ортопедии. Имплантация сложных конструкций в виде штифтов и пластин, выполненных из полилактида, продемонстрировала эффективность при остеосинтезе. Безопасность такого подхода подтверждена исследованиями, которые показали высокую биодоступность, отсутствие токсичности и выраженного воспалительного ответа в очаге имплантации 3, 4, 5. В косметологии полимолочная кислота применяется более 20 лет в виде разных вариантов исполнения, биодеградируемых нитей и сухой субстанции для дальнейшего приготовления инъекционных суспензий.
Учитывая растущий интерес к такому материалу, как полимолочная кислота в виде сухого вещества, очевидно, что и количество препаратов на ее основе закономерно будет увеличиваться. Если ограничиться только зоной лица, то на сегодняшний день на территории России зарегистрировано шесть препаратов с разными торговыми наименованиями. Практикующему специалисту важно понимать особенности каждого из них, ведь они могут существенно отличаться. Хотя в составе этих препаратов находится, по сути, одно и то же вещество, сами полимеры могут быть отличными друг от друга, что неизбежно влияет как на практическую составляющую применения продукта, так и на конечный клинический результат.
Несмотря на малое разнообразие суспензируемых препаратов на основе PLA, мы уже можем их категоризировать на гомополимеры (поли-L-молочная кислота) (рис. 1) и сополимеры (поли-D,L-молочная кислота) (рис. 2) 3.
Рис. 1. Гомополимеры: поли-L-молочная кислота, увеличение 1320 крат.
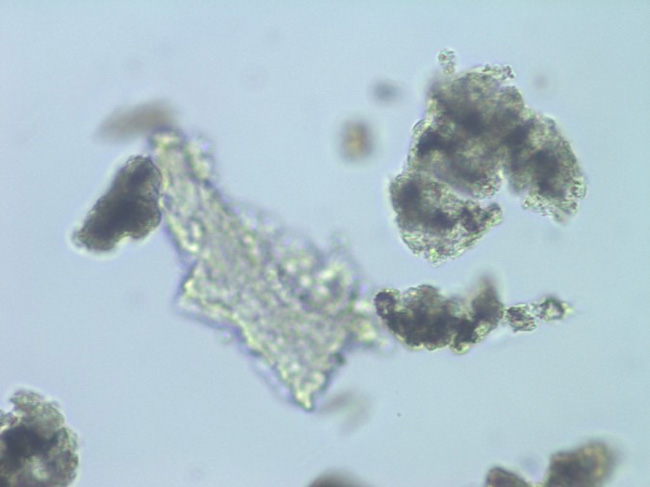
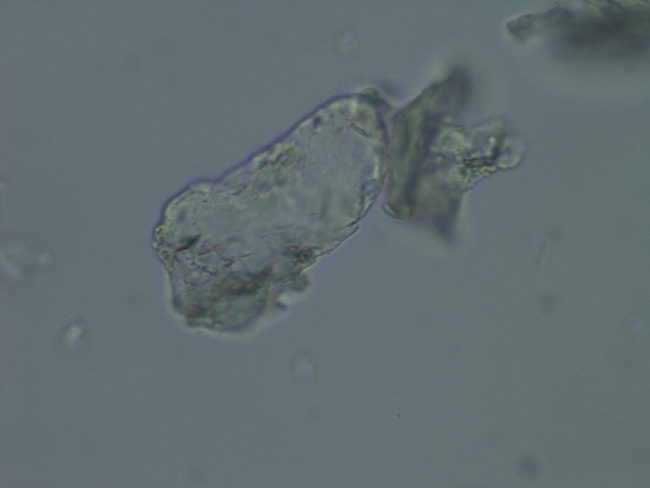
Рис. 2. Сополимеры: поли-D,L-молочная кислота, увеличение 1320 крат.
Такое деление связано с особенностями строения молекулы полимера и наличием в его цепочке соответствующих стерических изомеров молочной кислоты. В структуре поли-L-молочной кислоты повторяются левовращающиеся энантиомеры, что отражается на физических свойствах материала, обуславливая его кристаллическую структуру и низкую пластичность. Благодаря таким свойствам, как гидрофобность, высокая прочность, устойчивость к гидролитическому расщеплению и длительная биодеградация после имплантации в мягкие ткани организма человека, поли-L-молочная кислота нашла применение в создании сложных форм в виде нитей, фиксирующих штифтов и пластин. D-форма молочной кислоты, напротив, обладает аморфными свойствами и не вызывает интереса для синтеза высокомолекулярных структур в виду отсутствия достаточной прочности и быстрой гидролитической деструкции после имплантации. Но последовательная комбинация в цепи полимера право- и левовращающихся энантиомеров, т. е. D- и L- изомеров молочной кислоты, позволяет получать более пластичный, но тем не менее твердый готовый продукт, что дало возможность ученым создать ультрамалые надмолекулярные структуры в виде микросфер 6.
Накопленные знания о свойствах полимолочной кислоты и ее влияния на ткани дало нам понимание о механизмах ее стимулирующего действия. На биологический ответ со стороны человеческого организма на имплантируемый материал из PLA влияет ряд факторов: состав полимера (PLLA или PDLLA), молекулярная масса молекулы, размеры микрочастиц, качество рабочей суспензии, область и глубина имплантации. Изделия, выполненные из поли-L-молочной кислоты, подвергаются длительному ферментативному гидролизу в биологических тканях, длительность которого может достигать от 24 месяцев 7 (микрочастицы размером 10–200 мкм) до 7 лет (штифты, пластины) 8, 9 по разным литературным данным. А это означает, что время эффективного действия будет соответствовать времени полной биодеградации. Поли-D-лактат расщепляется в организме от 3 недель до 3 месяцев и обладает коротким стимулирующим эффектом. Сополимеры из поли-D,L-молочной кислоты в виде микрочастиц совмещают в себе эти свойства и, вероятно, обеспечивают двойную стимуляцию: быструю до 3 месяцев (D-форма) и длительную (L-форма) до 24 месяцев. Важной особенностью полилактидов является непрерывное действие: до тех пор, пока последняя микрочастица PLA не биодеградирует.
Соотношение микрочастиц разного размера в составе одного препарата также играет большое значение как на выраженность клинического эффекта, так и на его длительность. Микрочастицы маленького размера, менее 10 мкм, быстро элиминируются из организма при участии макрофагов и, соответственно, не окажут никакого биологического эффекта. Более крупные частицы, свыше 100 мкм, могут вызвать избыточное образование коллагена, что повышает риски среднесрочных и отдаленных нежелательных явлений и осложнений. Эффективными и безопасными считаются частицы размером от 40 до 70 мкм 10. В связи с этим практикующий специалист должен владеть информацией не только о химической формуле полилактида и диапазоне размеров микрочастиц «от и до», но и иметь представление о соотношении частиц разного размера в составе готового продукта. Это позволит повысить прогнозируемость эффективности процедур и снизить риски нежелательных явлений и осложнений.
Биологический ответ тканей на имплантацию микрочастиц полимолочной кислоты изучен и понятен и представляет собой два параллельно протекающих процесса: субклиническое воспаление и реакция на инородное тело, которым выступает сама микрочастица полимолочной кислоты. После имплантации PLA происходит медленный, но постоянный гидролиз полимера 10, промежуточным продуктом которого является молочная кислота. Накопление молочной кислоты приводит к закислению межклеточного вещества и таким образом поддерживает субклинический воспалительный процесс до тех пор, пока последняя микрочастица полилактида не будет разрушена. Признаки воспаления стихают к 6 месяцу и завершаются накоплением коллагена III типа. Вместе с тем в участках нахождения имплантата наблюдается очевидная реакция на инородное тело, которая гистологически подтверждается присутствием клеток инородного тела: многоядерных гигантских клеток инородных тел, тучных клеток, макрофагов, лимфоцитов. Уже в первый месяц после имплантации вокруг микросфер полимолочной кислоты формируется фиброзная капсула, а с 6 месяца наблюдается формирование и накопление коллагена I типа 11.
Способ приготовления и качество готовой рабочей суспензии не менее важны. В качестве суспензирующего агента всегда должна использоваться стерильная вода для инъекций, а в качестве местного анестетика – лидокаин 12. Нарушение правил приготовления суспензии может привести к изменению заряда на поверхности микрочастиц, их преципитации и оседанию, что сделает препарат непригодным для дальнейшего применения, а в случае имплантации такого материала может привести к развитию нежелательных явлений.
Технология инъекций имеет значение в отношении эффективности процедур и рисков возникновения осложнений. Общепринятым мнением является имплантация препаратов на основе полимолочной кислоты в поверхностный слой гиподермы (рис. 3). Не стоит пренебрегать и ограничениями, предусмотренными производителем: не вводить суспензию в запретные зоны, которыми могут являться область лба, носа, губ, периорбитальная область и др.
Эволюция технологий производства инъекционных препаратов на основе PLLA привела к появлению новых, более совершенных и удобных в использовании форм. Одним из представителей зарегистрированных изделий из полимолочной кислоты является продукт российской фармацевтической компании ИНГАЛ Repart® PLA, в состав которого входит сополимер поли-D,L-молочной кислоты. Для серийного выпуска Repart® PLA научно-производственным комплексом компании-производителя была разработана собственная технология двойной лифолизации. Отличительной особенностью изделия стала новая форма в виде сухой лиофилизированной пористой массы, благодаря которой время приготовления готовой рабочей суспензии сократилось до 1-3 минут по сравнению с использованием аналогичных препаратов.
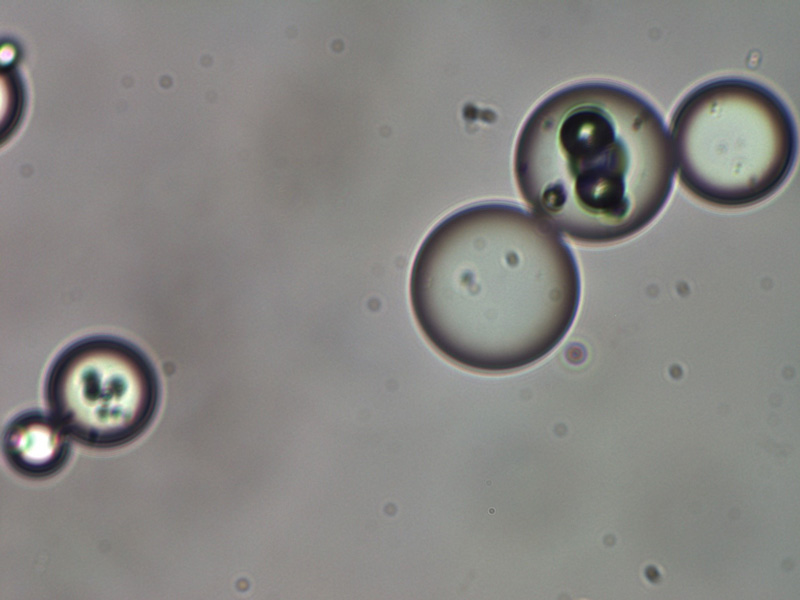
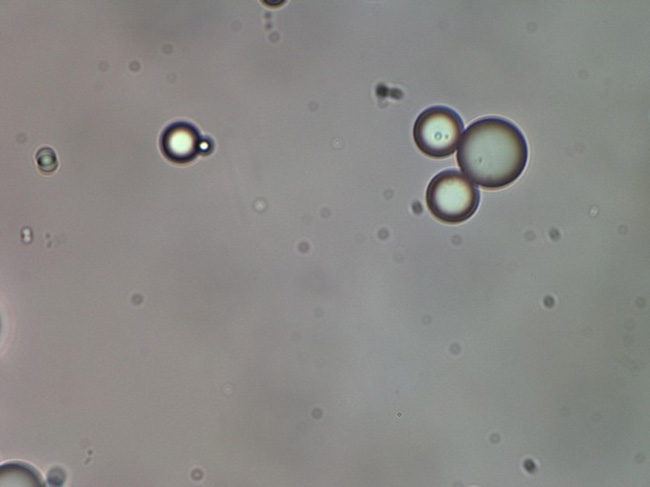
В производственном цикле применяется высокоточный аналитический метод лазерной дифракции, который позволяет оценивать и контролировать как размеры микрочастиц, так и их соотношение друг относительно друга. Центр распределения микрочастиц поли-D,L-молочной кислоты в Repart® PLA составляет 65 мкм. Идеальная сферическая форма микрогранул полилактида (рис. 4) и отсутствие эффекта преципитации после добавления воды для инъекций к сухому веществу обеспечивает беспрепятственное прохождение суспензии через иглы и канюли размером от 27 G.
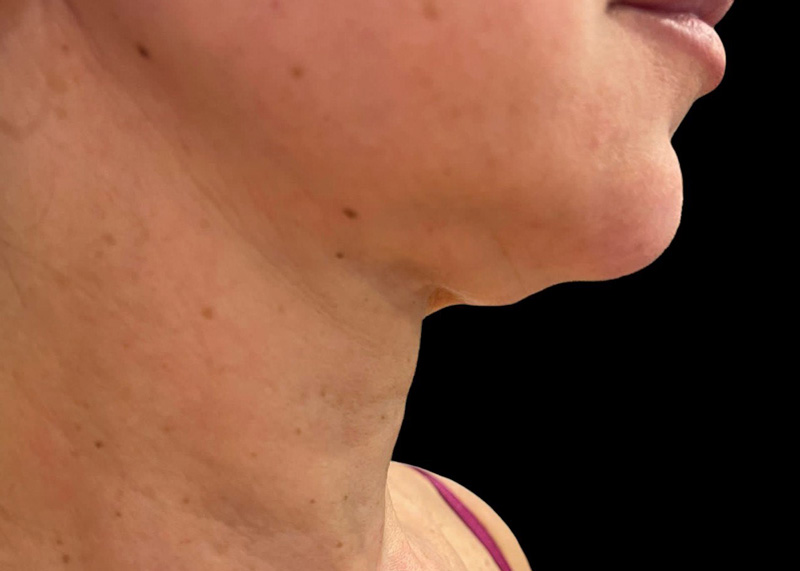
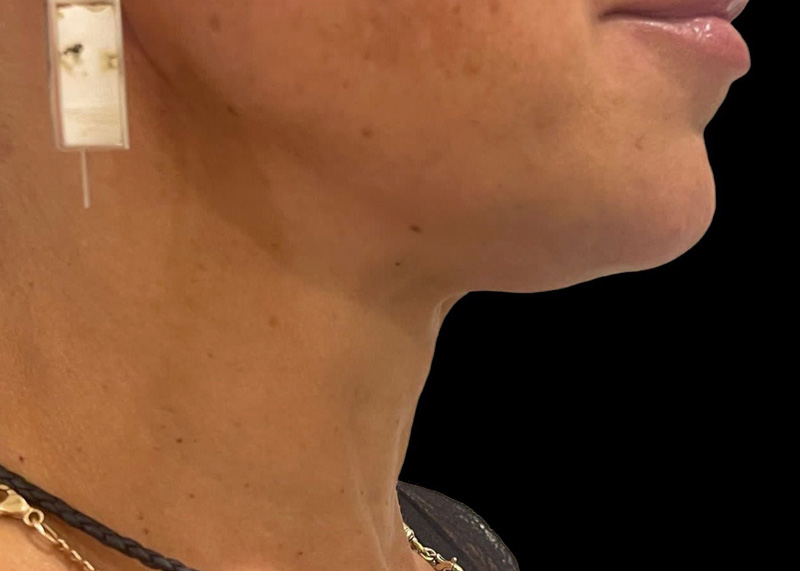
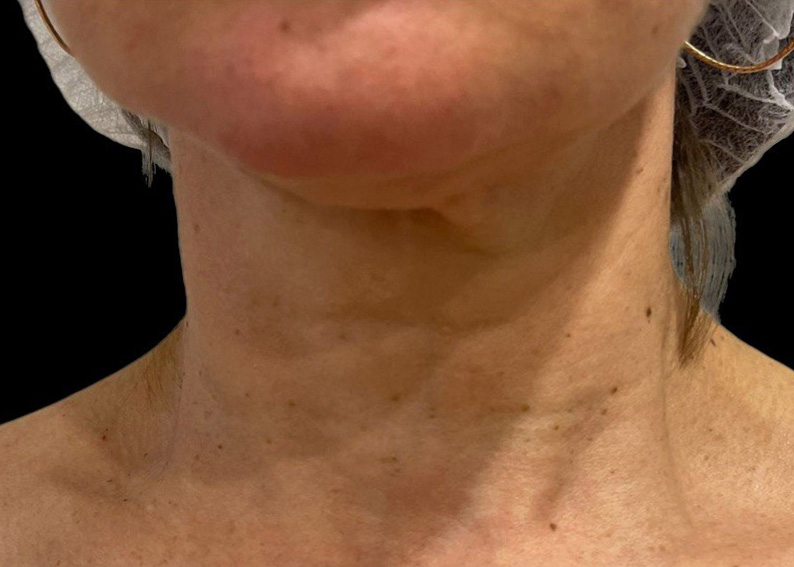
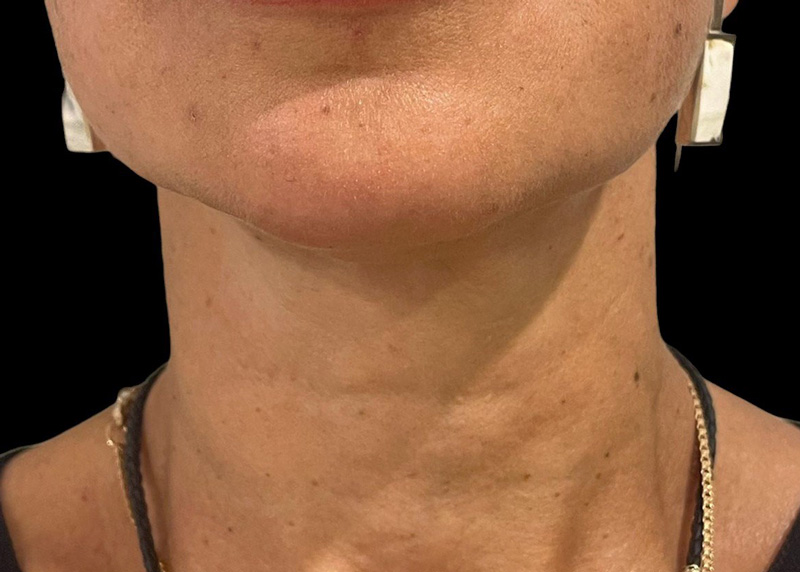
Рис. 5. Результаты применения Repart® PLA. Автор Петрова А.Е.
Источники:
- ISAPS international survey on aesthetic/cosmetic procedures, 2020. https://www.isaps.org/wp-content/uploads/2022/01/ISAPS-Global-Survey_2020.pdf.
- Haneke E. Skin rejuvenation without a scalpel. I. Fillers. Journal of Cosmetic Dermatology. 2006 Jun;5(2):157-67. doi: 10.1111/j.1473-2165.2006.00243.x. PMID: 17173591.
- Бычкова Н.Ю. Препараты полимолочной кислоты в косметологии. Интернет-издание индустрии красоты. 2009-2021 Портал 1nep.ru, 2022. https://www.1nep.ru/articles/preparaty-polimolochnoy-kisloty-v-kosmetologii/.
- Choochottiros C, Park E, Chin IJ. Synthesis and characterization of polylactide–poly(methyl methacrylate)copolymer by combining of ROP and AGET ATRP. J Ind Eng Chem 2012;18:993–1000.
- Zhang Y, Liang H, Luo Q, Chen J, Zhao N, Gao W, Pu Y, He B, Xie J. In vivo inducing collagen regeneration of biodegradable polymer microspheres. Regen Biomater. 2021 Jul 15;8(5):rbab042. doi: 10.1093/rb/rbab042. PMID: 34408912; PMCID: PMC8364987.
- Прокудин И. А. Деградация полимеров на основе полимолочной кислоты. Магистерская диссертация. 2017. http://earchive.tpu.ru/handle/11683/40069.
- Stein P, Vitavska O, Kind P, Hoppe W, Wieczorek H, Schürer NY. The biological basis for poly-L-lactic acid-induced augmentation. J Dermatol Sci. 2015 Apr;78(1):26-33. doi: 10.1016/j.jdermsci.2015.01.012. Epub 2015 Feb 7. PMID: 25703057.
- Дружинина Т.В., Талалаев С.Я., Çакиров Н.П., Щаденко С.В., Хабибуллин Ш.А, Хлусов И.А., Литвино- ва Л.С. Клеточные реакции на трехмерные матриксы из полимолочной кислоты и гидроксиапатита, полученные методом 3D-печати. Бюллетень сибирской медицины. 2016; 15. doi % 10.20538/1682-0363-2016-5-16–29.
- Jukkala-Partio K., Laitinen O., Vasenius J., Partio E.K., Toi- vonen T., Tervahartiala P., Kinnunen J., Rokkanen P. Heal- ing of subcapital femoral osteotomies fixed with self-rein- forced poly-Llactide screws. An experimental long-term study in sheep // Arch. Orthop. Trauma Surg. 2022; 122: 360–364.
- James M. Anderson, Matthew S. Shive. Biodegradation and biocompatibility of PLA and PLGA microspheres. Advanced Drug Delivery Reviews 28 (1997) 5–24. doi:10.1016/j.addr.2012.09.004.
- Могильная Г.М., Фомичева Е.В., Блатт Ю.Е. Морфогистохимическая характеристика импланта из полимолочной кислоты Кубанский научный медицинский вестник. 2018; 25(6): 114-118. DOI: 10.25207 / 1608-6228-2018-25-6-114-118.
- Baumann K, Alm J, Norberg M, Ejehorn M. Immediate Use After Reconstitution of a Biostimulatory Poly-L-Lactic Acid Injectable Implant. J Drugs Dermatol. 2020 Dec 1;19(12):1199-1203. doi: 10.36849/JDD.2020.5228. PMID: 33346524.

