С.Л. Тимербаева, кандидат медицинских наук, невролог, врач высшей категории, ведущий научный сотрудник Научного центра неврологии РАМН, вице-президент Межрегиональной общественной организации специалистов ботулинотерапии — МООСБТ (Москва)
Раскрывать истину следует в меру разума, прикрывая ее перед слабыми, чтобы не свести их с ума, пряча ее от злых, чтобы они не смогли схватить ее отрывки и сделать из них орудие разрушения. Из Обета Посвященных
Ботулинотерапия является одним из наиболее эффективных методов лечения целого ряда неврологических заболеваний, сопровождающихся мышечными спазмами (спастическая кривошея, блефароспазм, гемифациальный спазм, детский церебральный паралич, спастичность конечностей после инсульта и др.). В последнее время препараты ботулинического токсина типа А (БТА) стали активно использоваться в других областях клинической медицины, таких как урология, стоматология, офтальмология. Опыт применения БТА в косметологии с целью коррекции мимических морщин лица насчитывает около 20 лет. По данным Американского общества пластической хирургии в 2010 г. было проведено 2,43 миллиона инъекций БТА, что сделало их лидером среди нехирургических эстетических процедур (http://www.surgery.org). Применение БТА в эстетической практике сегодня не ограничивается только коррекцией гиперкинетических морщин. Препараты БТА эффективны также при лечении локального гипергидроза, в комплексной терапии патологических рубцов и ряда других состояний.
Одной из проблем ботулинотерапии является отмечаемое в редких случаях отсутствие эффекта лечения или его снижение при долгосрочном применении. Причины этого могут быть различными — от технических ошибок врача при выполнении процедуры введения до формирования антител, полностью или частично блокирующих действие токсина. В клинической практике важно владеть информацией о факторах риска развития данных состояний, для того чтобы уметь адекватно оценивать возникшую ситуацию, представлять пути профилактики и преодоления недостаточных результатов лечения.
Ботулинический токсин как антиген
Ботулинический токсин типа А, лежащий в основе современной ботулинотерапии, представляет собой протеин, состоящий из двух цепей: тяжелой с молекулярной массой 100 кДа (848 аминокислот) и легкой с молекулярной массой 50 кДа (448 аминокислот). Анаэроб Cl. botulinum продуцирует БТА в виде единой полипептидной цепочки, не обладающей токсическим действием. Под влиянием эндопептидаз полипептидная цепочка расщепляется на легкую и тяжелую цепи, объединенные дисульфидной связью (рис. 1). Таким образом, собственно токсин образуется в процессе посттрансляционной модификации белка. Тяжелая цепь ботулотоксина (БТ) имеет высокое сродство к специфическим акцепторам на пресинаптической мембране холинэргических терминалей мотонейронов, участвуя в этапе связывания БТ с выбранной мишенью. Легкая цепь обладает цинк-зависимой протеазной активностью и в цитоплазме нейронов разрушает один из транспортных белков (SNAP-25), осуществляющих экзоцитоз ацетилхолина, что делает невозможным высвобождение этого медиатора в синаптическую щель, прерывает нервно-мышечную передачу и приводит к состоянию обратимой локальной миорелаксации.
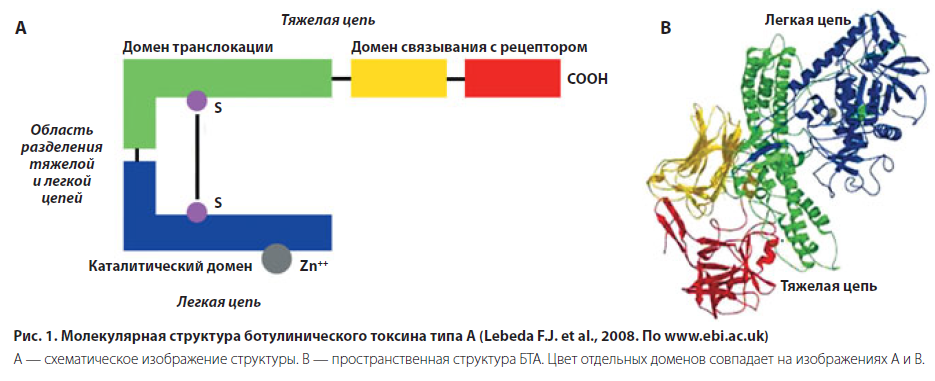
Все серотипы ботулинического токсина продуцируются Cl. botulinum в виде белковых комплексов, содержащих как собственно токсин, так и один или более нетоксиновых белков. Ботулинический токсин типа А может быть представлен комплексом с молекулярной массой 900 кДа (LL-форма БТ). В то же время тип А наряду с типами В, С, D (гемагглютинин-позитивными) и G может также существовать в виде комплекса с молекулярной массой 500–600 кДа (L-форма) или 300 кДа (М-форма). Коммерческие препараты нового поколения содержат ботулинический токсин типа А весом 150 кДа, свободный от комплексообразующих белков. Frevert J., Dressler D., 2010 [2]
Ботулинические токсины секретируются облигатным анаэробом Cl. botulinum как комплекс с токсин-ассоциированными клостридиальными белками (neurotoxin associated proteins, NAP), имеющими гемнаглютининовую и не гемагглютининовую природу. Роль комплексообразующих белков — защита нейротоксина от деградации в кислой среде желудочно-кишечного тракта при алиментарном заражении и участие в абсорбции токсина в кишечнике [1, 2]. В исследованиях in vitro и in vivo показано, что токсин-ассоциированные белки способствуют повышению эндопептидазной активности легкой цепи нейротоксина [3, 4]. Наличие функциональной взаимосвязи токсина с комплексообразующими белками подтверждают данные о кодировании токсина и комплексообразующих белков расположенными рядом кластерами генов [2].
Поскольку и токсин, и комплексообразующие белки являются антигенами, они могут запускать процессы формирования соответствующих антител.
Антитела, формирующиеся в ответ на поступление в организм нейротоксина, — клинически значимые. Они могут взаимодействовать с токсином и нейтрализовать его биологическую активность, поэтому обозначаются как «блокирующие» или «нейтрализующие». Главной мишенью для нейтрализующих антител служит тяжелая цепь нейротоксина.
Антитела к токсин-ассоциированным белкам не влияют на активность БТ и называются «не нейтрализующими». Однако через цитокиновый путь комплексообразующие белки также могут быть триггером образования нейтрализующих БТ антител [5].
Первичная и вторичная неэффективность ботулинотерапии
Под первичной неэффективностью ботулинотерапии понимают отсутствие результата при первом использовании ботулинического токсина, что встречается достаточно редко [6].
К причинам, определяющим недостаточный эффект ботулинотерапии или даже полное отсутствие миорелаксирующего действия, относят:
• нечеткое определение цели лечения, ошибки при оценке показаний к проведению терапии у конкретного пациента, выборе мышц-мишеней и другие технические погрешности;
• использование недостаточной дозы токсина (известно, что эффект ботулинотерапии является дозозависимым);
• сниженную биологическую активность токсина, например, при несоблюдении условий хранения и транспортировки;
• клинические подтипы с редуцированной чувствительностью к БТ (апраксия открывания век и др.);
• индивидуальную редуцированную чувствительность к БТ, в том числе связанную с изменением свойств мембранных акцепторов токсина.
При долгосрочной успешной терапии препаратами БТ может развиваться вторичная неэффективность, которая оценивается как объективная или субъективная, полная или частичная, постоянная или временная. В клинической практике, в том числе и в косметологии, отмечается значительная межиндивидуальная вариабельность эффекта, а у одного и того же пациента результат коррекции может отличаться в различных зонах лица. Так, введение БТА приводит к более выраженной миорелаксации в области лба по сравнению с межбровной и параорбитальной зонами.
Клинически пациентов с вторичной нечувствительностью определяют как случаи с анамнезом, по крайней мере, двух успешных инъекций (степень улучшения не менее 20% и/или наличие релаксации инъецированных мышц с потенциалами денервации согласно электромиографии) [7, 8]. Полная вторичная неэффективность обычно наблюдается в первые 2–3 года лечения с предшествующим периодом частичной неэффективности. После 4 лет терапии БТ вторичная неэффективность является редким состоянием [6].
Среди причин вторичной неэффективности ботулинотерапии выделяют влияние психологических факторов (депрессия), обострение течения основного заболевания, а также многочисленные технические ошибки. В процессе лечения, например, спастической кривошеи, нередко наблюдается смена паттерна дистонических мышц-мишеней, в связи с чем успешные ранее схемы инъекций оказываются мало результативными. Изменение свойств мембранных акцепторов БТА в период терапии также может привести к потере чувствительности. Кроме этого к причинам вторичной неэффективности относят редуцированную биологическую активность препарата, и, наконец, иммунорезистентность, связанную с формированием нейтрализующих антител [6, 9].
Какова значимость иммунорезистентности в неэффективности ботулинотерапии?
Наличие нейтрализующих БТ антител до начала лечения не было доказано ни в контрольных сериях, ни у пациентов, перенесших ботулизм или столбняк. При ботулизме новорожденных могут быть стабильные титры анти-БТ антител, но эта проблема является предметом дебатов [6].
Частота выявления клинически значимых блокирующих токсин антител в процессе лечения БТ по данным разных авторов составляет при спастической кривошее 2% [10] и 1,2% [11]; при спастичности у взрослых — 6% [12]; при детском церебральном параличе — 6% [13].
Из исследований, посвященных проблеме иммунорезистентности к БТ, следует отметить мета-анализ результатов 16 крупных контролируемых и проспективных открытых исследований продолжительностью от четырех месяцев до двух и более лет с итоговой выборкой из 2240 пациентов, касающихся применения препарата onabotulinumtoxinA (Ботокс) [8]. Целью исследования являлась оценка частоты сероконверсии (образования нейтрализующих антител) при проведении ботулинотерапии по различным, в том числе косметологическим показаниям. Авторы исследования проанализировали также связь между образованием нейтрализующих антител, клиническим эффектом и нежелательными явлениями, которые могут иметь иммунную природу.
Анализ соответствовавших критериям отбора исследований показал, что разовая доза Ботокса варьировала от 10–20 ЕД до 20–500 ЕД, количество процедур — от одной до 15 (в среднем — 3,8). Число пациентов, у которых отмечалась конверсия из исходно серонегативного статуса к серопозитивному на любом временном этапе терапии, составило:
• 1,28% при спастической кривошее (4 пациента из 312);
• 0,32% при спастичности после перенесенного инсульта (1 пациент из 317);
• 0% (наблюдения за 22 пациентами) при гиперактивном мочевом пузыре.
В целом сероконверсия наблюдалась у 11 (вместе с пациентами косметологического профиля) из 2240 пациентов (0,49%), однако лишь в 3 случаях у них имела место клиническая неэффективность терапии. К моменту завершения исследования серопозитивными оставались 0,2% пациентов в условиях продолжения эффективной ботулинотерапии. Результаты данного, наиболее обширного и доказательного, исследования показали, что частота образования антител к БТА (Ботокс) очень низка и чрезвычайно редко приводит к развитию неэффективности терапии. Следует также отметить, что у пациентов с нейтрализующими БТ антителами не отмечалось каких-либо местных или системных нежелательных явлений иммунной природы.
Методы выявления иммунорезистентности к ботулиническому токсину и их практическая значимость
Выделяют несколько групп диагностических методов, позволяющих выявлять наличие иммунорезистентности к БТ, среди которых различают клинические, иммунохимические и биологические тесты. Чувствительность и специфичность этих методик существенно отличаются, а значит, неодинакова и их клиническая ценность относительно подтверждения или опровержения иммунологических механизмов развития неэффективности терапии.
Клинические тесты
Фронтальный тест (Frontalis Antibody Test; FTAT) или тест нахмуривания бровей (unilateral brow injection test, UBI test) основаны на контроле функции лобной мышцы или мышц, нахмуривающих брови, до и после унилатерального введения в них БТ (рис. 2). К недостаткам этих тестов относят отсутствие возможности количественной оценки результатов и исследований по определению их чувствительности и специфичности. Преимущества метода — наглядность и простота исполнения [11, 14].
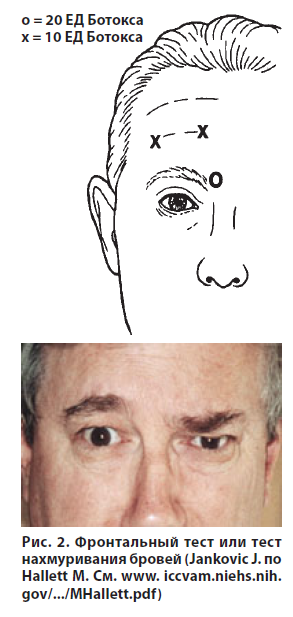
Отсутствие эффекта БТ проявляется асимметрией лицевых мышц через 1–2 недели после инъекции в лобную и/или сморщивающую бровь мышцу с одной стороны, особенно заметной при активной мимике. В условиях нечувствительности к лечению миорелаксирующий эффект не развивается, что проявляется сохранением симметрии как в покое, так и при сокращении мышц.
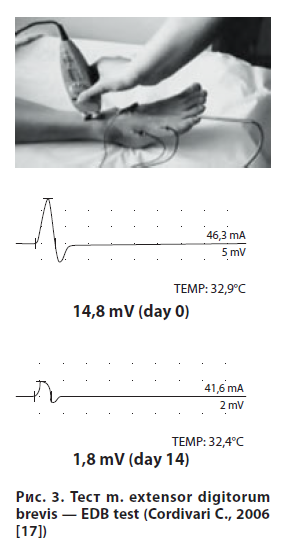
Тест m. extensor digitorum brevis (EDB test) подразумевает электростимуляцию n. peroneus и ЭМГ-измерение амплитуды потенциала действия мышцы (короткий разгибатель большого пальца стопы) до и спустя 2–4 недели после введения БТ (20 ЕД Ботокса). EDB тест — достаточно простой способ детекции резистентности к БТ с чувствительностью на уровне биологических методов. Проведенные исследования показали, что чувствительность EDB теста составляет 80%, а специфичность — 94% [15–17].
Судомоторный тест основан на количественной оценке функции потоотделения до и после внутрикожной инъекции БТ. Возможность различать пациентов с наличием и отсутствием клинически значимых антиботулотоксиновых антител по данным судомоторного тестирования была показана результатами качественной (йодо-крахмальная проба Минора) и количественной (гигрометрия) оценки термоиндуцированного потоотделения. Недостатком метода является отсутствие стандартизации [18].
Иммунохимические методы
Иммуноферментный анализ с фиксированным антигеном (ELISA) дает возможность проведения количественной оценки уровня антител, но не позволяет различать нейтрализующие и не нейтрализующие токсин антитела, в связи с чем он характеризуется низкой чувствительностью и специфичностью, а потому высока вероятность получения ложнопозитивных результатов [6].
К достоинствам другого иммунохимического метода — иммунопреципитации (Immuno Precipitation Assay, IPA) относят отсутствие необходимости использовать животных (мышей), возможность количественной оценки уровня антител, чувствительность, простоту исполнения (анализ проводится в течение нескольких часов), экономичность. Недостаток — низкая специфичность: клиническая значимость отрицательного ответа составляет 100%, положительного — лишь 24% [19].
Все разновидности методов иммунодетекции in vitro, включая упомянутые выше, а также иммуноблоттинг, являются чувствительными, однако определяют в сумме нейтрализующие и не нейтрализующие антитела, поэтому не являются специфичными [8].
Биологические тесты
В настоящее время к методам, позволяющим достоверно определять наличие нейтрализующих антител, относят биологические исследования, такие как тест защиты мышей и мышиный диафрагмальный тест.
Тест защиты мышей/летальности мышей (mouse protection assay, MPA; mouse lethality assay, MLA) считается «золотым стандартом» качественного и количественного анализа уровня токсин-нейтрализующих антител. Данный метод подразумевает проведение тестирования токсического эффекта БТ на мышах. К тестовой системе добавляют исследуемую сыворотку крови: при наличии нейтрализующих антител токсический эффект БТ снижается и соответственно увеличивается количество выживших животных. Из недостатков метода отмечают необходимость использования большого количества мышей, длительность выполнения (в течение нескольких
дней) и полуколичественную оценку результатов. Тест защиты мышей является высокоспецифичным (100%), позволяя выявлять нейтрализующие токсин антитела, однако его чувствительность ниже, чем у иммунохимических методов [20].
Обнаружение нейтрализующих антител методом защиты мышей не всегда коррелирует с развитием неэффективности ботулинотерапии: M. Naumann с соавторами приводят данные о 7 пациентах, у которых, несмотря на выявленную методом MPA сероконверсию, клинический эффект после введения БТА реализовался в полном объеме [8]. Объяснение этому наблюдению, вероятно, следует искать в наличии низкого титра антител, не способных блокировать клинический эффект БТА.
Мышиный диафрагмальный/гемидиафрагмальный тест (mouse diaphragm assay, MDA; hemidiaphragm assay, HDA): парализующий эффект БТ тестируется на препарате мышиной диафрагмы. В качестве определяемого параметра используется время 50% редукции амплитуды контрактильного ответа диафрагмальной мышцы. Достоинства метода — количественная оценка результатов, быстрое выполнение (в течение нескольких часов), простота исполнения, достаточно высокая чувствительность, превосходящая этот показатель у теста защиты мышей. Данный метод также соответствует роли «золотого стандарта» [8, 21–23].
Всемирная организация здравоохранения (ВОЗ) для определения антител к БТ рекомендует применять метод защиты мышей, который остается основным «золотым стандартом». Именно с использованием этого метода выполняется подавляющее число современных исследований [8].
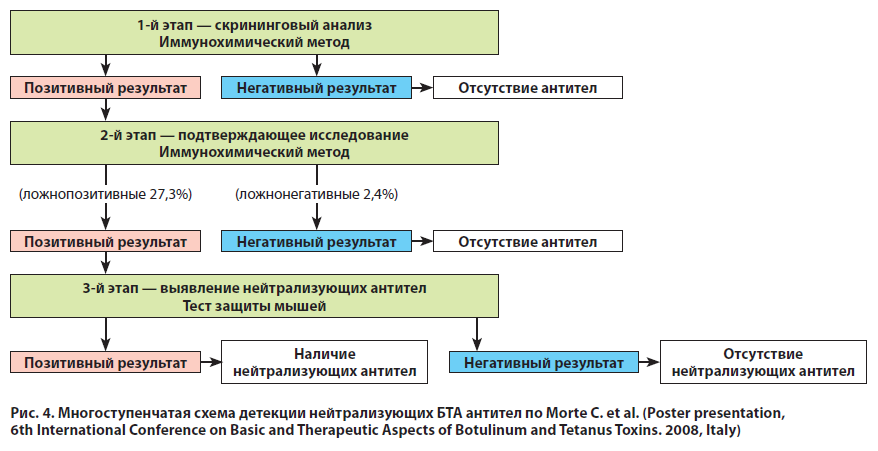
Достоверное обнаружение нейтрализующих БТ антител обычно представляет собой многоступенчатый процесс, включающий несколько тестов, сменяющихся в направлении от чувствительных, но менее специфичных (скрининговых) до методов «золотого стандарта» (рис. 4).
Интерпретация результатов тестирования антител и практические рекомендации
До недавнего времени считали, что возможны только два варианта интерпретации результатов тестирования антител:
• отсутствие или наличие нейтрализующих антител;
• антитела полностью блокируют действие БТ.
Многолетний клинический опыт свидетельствует о том, что между наличием антител, даже блокирующих БТ, и отсутствием клинического эффекта нельзя однозначно ставить знак равенства. Наблюдение за больными с различными заболеваниями, у которых эффективность лечения препаратами БТА сохраняется, несмотря на наличие нейтрализующих БТ антител, позволило высказать предположение о зависимости терапевтического эффекта БТА не только от наличия или отсутствия нейтрализующих антител как таковых, но и от баланса между использованными дозами БТА и уровнями блокирующих антител [24].
На сегодняшний день разработаны практические рекомендации по интерпретации результатов анализа антител разными методами, позволяющие делать клинически значимые выводы об иммунологической природе неэффективности ботулинотерапии.
Положительный результат тестирования методом защиты мышей («золотой стандарт») подтверждает роль нейтрализующих антител в развитии вторичной неэффективности лечения. Негативный результат данного теста эту ситуацию не исключает (титры антител ниже клинически значимого уровня). По данным D. Dressler с соавторами, при уровне нейтрализующих антител меньше 0,002 ЕД/мл по результатам мышиного дифрагмального теста роль иммунорезистентности в развитии неэффективности лечения больных с дистонией маловероятна [6].
Хотя функциональная значимость различных титров нейтрализующих БТА антител до настоящего момента недостаточно понятна, принято считать, что высокий титр антител может полностью блокировать действие нейротоксина, обусловливая иммунорезистентность, полную вторичную неэффективность лечения и лишая пациентов возможности применения одного из самых обнадеживающих методов лечения [24].
Феномены циркуляции нейтрализующих антител
Активный интерес к процессам образования и циркуляции нейтрализующих БТ антител связан с различными аспектами: созданием вакцины и сыворотки для лечения ботулизма, а также преодолением иммунологически обусловленной неэффективности терапии.
Клинико-экспериментальное исследование с использованием пентавалентного ботулинического токсоида показало, что через год антитела исчезают приблизительно у половины серопозитивных пациентов [25].
D. Dressler и H. Bigalke опубликовали результаты проспективного исследования, проведенного с целью изучения динамики титров нейтрализующих БТА антител в различные периоды времени (1,5–6 лет) после прекращения лечения [26]. В исследование были включены 13 пациентов с дистонией и полной вторичной неэффективностью лечения: ср. возраст в начале лечения БТА — 48,2±11,3 года; ср. количество курсов инъекций препаратов Ботокс и/или Диспорт — 7,7±2,9; ср. длительность лечения — 678,8±385,6 дней; ср. интервал между инъекциями — 90,4±35,5 дней; ср. разовая доза БТА — 546,7±336,9 EМU; ср. кумулятивная доза — 4185,1±3375,7 EМU (EМU — эквивалентные мышиные единицы. 1 EMU соответствует 1 ЕД Ботокса или 3 ЕД Диспорта). В течение периода наблюдения, который длился, по крайней мере, 750 дней после выявления полной вторичной неэффективности лечения, нейтрализующие токсин антитела определяли с помощью мышиного диафрагмального теста 2 и более раз. Было установлено, что титр нейтрализующих антител уменьшился у 8 из 13 пациентов. Этот эффект отмечался между 500 и 1750 днями (1,5–5 лет) после прекращения инъекций БТА. В период 1250–2250 дней (3,5–6 лет) уровень антител снизился до 0,002 ЕД/мл. В то же время у 5 из 13 пациентов титр антител не уменьшился. В 3 случаях срок наблюдения был менее 1500 дней, в связи с чем у пациентов сохранялась возможность снижения титра антител; 2 других пациента наблюдались на протяжении 2400 дней без какой-либо отчетливой динамики (рис. 5).
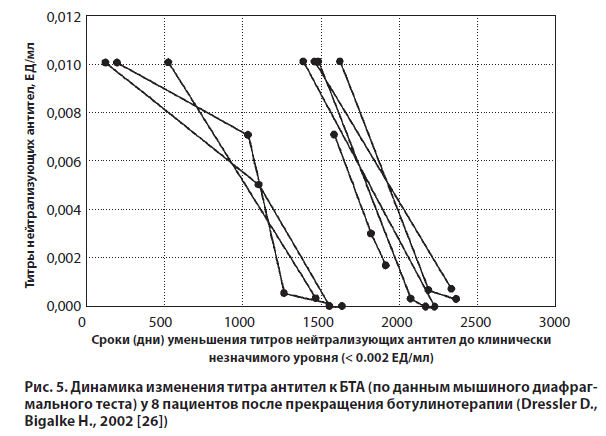
Согласно предположению о том, что процессы формирования антител и их элиминации могут определяться реактивностью иммунной системы пациента, дозой БТА, а также схемой терапии, авторы исследования провели сравнительный анализ отдельных характеристик пациентов (пол, возраст, начало лечения) и определенных параметров терапии (количество курсов инъекций, средний интервал между инъекциями, средняя разовая и кумулятивная доза БТА, длительность лечения) в группах с наличием или отсутствием феномена уменьшения титра нейтрализующих антител. В рамках изучаемой когорты пациентов не удалось установить статистически значимой зависимости процесса иммунообразования от указанных выше факторов. Полученные данные позволили сделать вывод о том, что после прекращения неэффективной ботулинотерапии у большинства пациентов с выявленной иммунорезистентностью титр нейтрализующих антител со временем снижается ниже клинически значимого уровня, предоставляя им возможность возобновления лечения.
Образование антител к ботулиническому токсину в косметологической практике
До 2007 г. публикации о наличии нейтрализующих БТ антител у пациентов, которым вводили препараты БТА по эстетическим показаниям, отсутствовали. Первое сообщение касалось иммунологически обусловленной вторичной неэффективности ботулинотерапии гипертрофии жевательных мышц у 20-летней пациентки после четырех инъекций Ботокса (по 60 ЕД с интервалом 4–5 месяцев) [27]. Вторичная нечувствительность была подтверждена вначале положительным фронтальным тестом, а затем антитела к БТА определяли с помощью иммуноферментного анализа ELISA и биологического теста защиты мышей. Особенностью данного случая
является тот факт, что иммунорезистентность развилась при лечении сравнительно невысокими дозами препарата, известного как «новый Ботокс» с низким содержанием белка.
В 2009 г. I. Lawrence и R. Moy сообщили о 5 пациентах с выявленными методом радиоиммунной преципитации антителами из 1554 (0,32%), получавших инъекции abobotulinumtoxinA (Диспорт) для коррекции межбровных морщин [19]. Однако проверка полученных результатов с помощью биологического теста защиты мышей не подтвердила наличие антител ни у одного из этих пациентов, что позволило говорить о том, что использование стандартных доз БТА и общепринятых схем ботулинотерапии не приводит к формированию нейтрализующих токсин антител. В описанных случаях результаты иммунохимического анализа были расценены как ложнопозитивные, так как обнаруженные антитела не влияли ни на эффективность лечения (длительность эффекта миорелаксации у серопозитивных пациентов — 103,3 дня, у серонегативных — 89,4 дня), ни на его безопасность.
Согласно данным мета-анализа М. Naumann с соавторами, формирование нейтрализующих антител у исходно серонегативных пациентов, которым проводилась коррекция межбровных морщин препаратом Ботокс, наблюдалось лишь в 0,28% случаев (2 пациента из 718) [8]. Перед включением в исследование коррекция межбровных морщин БТ этим пациентам не проводилась, однако информация о том, получали ли они ранее ботулинотерапию по другим показаниям, отсутствовала. Оба пациента получили инъекции в разовой дозе 20 ЕД, тест на антитела дал положительный результат во время последней процедуры, при этом, что очень важно,
эффективность терапии сохранялась. На заключительном визите после прекращения лечения тест на антитела был отрицательным во всех случаях.
При лечении Ботоксом пациентов с аксиллярным гипергидрозом формирование нейтрализующих антител отмечено у 4 из 871 пациента (0,46%), которые исходно были серонегативными, а 3 пациента до момента включения в исследование никогда не получали ботулинотерапию. В трех случаях сероконверсия произошла после введения 100 ЕД Ботокса, в одном — после введения 150 ЕД. На заключительном визите нейтрализующие антитела сохранялись у 2 пациентов (0,2%). Важно отметить, что у всех пациентов, несмотря на наличие антител, отмечался хороший ангидротический эффект.
В 2010 г. D. Dressler с соавторами сообщили о 4 случаях формирования нейтрализующих антител при проведении терапии БТ по косметологическим показаниям [28]. Один пациент получил инъекции Диспорта, 2 — инъекции Ботокса, 1 — обоих препаратов. Вторичная неэффективность развилась после 3, 5, 10 и 13 инъекций, общая продолжительность терапии составила 18, 16, 25 и 65 месяцев, кумулятивные дозы Ботокса — 240 ЕД, Диспорта — 1180 и 245 ЕД, а в случаях применения обоих препаратов — 270 ЕД Диспорта и 120 ЕД Ботокса. Средние интервалы между инъекциями — 87, 273, 150 и 190 дней; ср. разовая доза Ботокса — 80 ЕД, Диспор-
та — 68 и 82 ЕД, при сочетании препаратов — 30 ЕД Ботокса и 30 ЕД Диспорта. Титры антител по данным мышиного диафрагмального теста составляли 0,0027; 0,007 и более 0,01 ЕД/мл. Предполагаемыми факторами риска вторичной неэффективности лечения явились бустерные (повторные инъекции с интервалом менее 2 недель) инъекции (2 пациента) и повышенная реактивность иммунной системы (1 пациент). В последнем, четвертом, наблюдении причины формирования блокирующих антител остались неясными.
Возможности преодоления и профилактики иммунорезистентности к БТА
Повышение дозы БТА
Клиническая практика свидетельствует о том, что увеличение дозы БТА может быть успешным в случаях либо частичной неэффективности лечения, либо низких титров блокирующих БТ антител. В подобных ситуациях увеличение дозы позволяет сохранить эффективность терапии без последующего повышения уровня антител и развития нежелательных явлений [24].
Использование препаратов других типов ботулотоксина или других препаратов БТА
В случае неэффективности терапии препаратами БТА результативной оказывается терапия с использование токсина другого серотипа, например типа В (препарат Миоблок/Нейроблок) [22, 29]. В экспериментальных исследованиях отмечен эффект миорелаксации после введения БТ типа F. Однако после повторных инъекций к этим препаратам также вырабатываются антитела.
Что касается сопоставления неэффективности лечения наиболее часто применяемыми в клинической практике препаратами БТА (Ботокс и Диспорт), в литературе отсутствуют доказательные данные о том, что нейтрализующие антитела могут различным образом блокировать токсин в их составе [30].
Возможности инактивации или удаления нейтрализующих антител
К методам инактивации или удаления нейтрализующих антител относят плазмаферез и иммуноадсорбцию, которые нуждаются в дальнейших исследованиях. С подобной целью могут быть использованы препараты-иммуносупрессоры (например, стероиды), а также иммуноглобулины, эффективность которых на сего дняшний день нельзя считать полностью доказанной из-за малого числа наблюдений [6].
С практической точки зрения методики уменьшения пула нейтрализующих антител с использованием комбинации плазмафереза и иммуноадсорбции путем внутривенного введения иммуноглобулина являются малорезультативными. Стратегия ожидания и наблюдения сегодня считается более предпочтительной и основывается на данных о снижении титра нейтрализующих антител после прекращения лечения БТ до уровня, позволяющего восстановить эффективную терапию [6, 21, 31–33].
Профилактика формирования нейтрализующих антител и развития неэффективности терапии
Для предотвращения формирования блокирующих БТ антител следует избегать установленных на сегодня факторов риска. К ним относятся [33–36]:
• высокая разовая доза препарата БТА;
• короткие интервалы между инъекциями (менее 3 месяцев);
• повторные введения препарата в течение 2 недель («бустерные» инъекции);
• индивидуальные особенности реактивности иммунной системы пациента.
Наконец, большое значение имеет качество препарата: использование незарегистрированных, фальсифицированных или контрафактных препаратов БТ, многие из которых могут обладать большей иммуногенностью, сопряжено с повышенным риском формирования вторичной нечувствительности к терапии. Зачастую неэффективность лечения связана с низким качеством (активностью) подобных препаратов.
Связь белковой нагрузки препаратов БТА с антигенностью
Предположение о том, что более низкая белковая нагрузка препарата БТА соответствует сниженной иммуногенности, высказывалось достаточно давно [37].
Исследования на животных показали зависимость выраженности иммунного ответа от количества поступившего в организм потенциального антигена. В отношении препаратов БТА это означает, что увеличение доли нетоксиновых белковых компонентов в составе нейротоксинового комплекса (включающего активную и неактивную формы токсина, а также комплексообразующие белки), вероятно, приводит к повышению риска формирования антител. Именно это было показано в сравнительном экспериментальном исследовании антигенности двух препаратов БТА, имеющих одинаковую специфическую активность, но разную белковую нагрузку: препарат, обозначенный как «оригинальный Ботокс», содержал приблизительно 25 нг нейротоксинового белкового комплекса на 100 ЕД, другой, «новый Ботокс», — приблизительно 5 нг комплекса на 100 ЕД. При ежемесячном внутримышечном введении кроликам по 3 ЕД/кг одного из препаратов (всего 8 инъекций) было установлено, что при использовании «оригинального» препарата нейтрализующие антитела сформировались у 8 из 9 животных (89%), а при использовании «нового» препарата со сниженной антигенной нагрузкой — у 1 из 9 животных (11%). На основании полученных данных был сделан вывод о меньшем иммуногенном потенциале препарата БТА с более низкой протеиновой нагрузкой [38].
Результаты экспериментальных исследований позже были подтверждены клинической практикой. По статистике FDA (Управление по контролю качества продуктов питания и лекарственных средств США) после множественных инъекций «оригинального Ботокса» в дозе 200 ЕД нейтрализующие антитела формировались у 9,5% пациентов со спастической кривошеей, однако после 1998 г., когда начал использоваться препарат нового состава, частота обнаружения нейтрализующих антител среди пациентов, получавших инъекции в течение 1–4 лет, снизилась до 1,2% [11]. Данные D. Dressler с соавторами также подтвердили сниженную иммуногенную активность «нового Ботокса», позволившую уменьшить риск формирования нейтрализующих антител с 5 до 1% [29, 35].
Повышение иммуногенности БТА в присутствии комплексообразующих белков может объясняться адьювантными свойствами некоторых гемагглютининов, в частности HA1 и HA3b, в составе комплекса [39, 40]. Использование новых препаратов БТА со сниженной антигенной нагрузкой, возможно, станет одним из способов профилактики формирования вторичной иммунообусловленной неэффективности терапии.
К таким новациям в области ботулинотерапии относится препарат БТА Ксеомин, свободный от комплексообразующих белков [41]. Проведенные к настоящему времени экспериментальные и клинические исследования препарата Ксеомин свидетельствуют об отсутствии формирования к нему нейтрализующих антител и развития иммунорезистентности. Тем не менее в клинических исследованиях Ксеомина, проведенных в США с участием 1080 пациентов, в 12 исходно серонегативных случаях (1,1%) в период лечения были выявлены нейтрализующие антитела (данные мышиного диафрагмального теста). Следует отметить, что все эти пациенты ранее
лечились препаратами БТА, содержащими комплексообразующие белки. По мнению J. Frevert с соавторами, в данных наблюдениях нельзя исключить версию о запуске процесса формирования антител до начала терапии Ксеомином. Более того, появление нейтрализующих антител не отразилось на эффективности лечения, а у одного пациента к концу исследования тест на антитела стал отрицательным [2]. Таким образом, внедрение в клиническую практику препарата БТА, свободного от комплексообразующих белков, возможно, позволит снизить риск формирования вторичной неэффективности терапии, связанной с иммунорезистентностью, однако для окончательных выводов требуется проведение широкомасштабных многолетних сравнительных клинических исследований.
Заключение
Лечение препаратами БТА позволяет существенно повысить качество жизни пациентов, поэтому клинические аспекты, связанные с эффективностью ботулинотерапии, имеют особую значимость и актуальность.
Иммунный ответ на любые лекарственные препараты белкового происхождения может проявляться как аллергическими реакциями (гиперчувствительностью), так и формированием нейтрализующих антител, способных в той или иной степени редуцировать терапевтический эффект.
Следует отметить, что, согласно данным многочисленных клинических исследований, у пациентов, в организме которых в процессе лечения сформировались нейтрализующие БТ антитела, не отмечалось каких-либо местных или системных нежелательных явлений иммунной природы.
Ввиду того, что в опубликованных исследованиях общее число пациентов с сероконверсией очень мало, пока не удалось обнаружить явную зависимость степени иммунного ответа от различных факторов, характеризующих как пациентов, так и параметры терапии (пол, возраст, этническая принадлежность пациентов, количество курсов инъекций, средний интервал между инъекциями, средняя разовая и кумулятивная дозы БТ, длительность лечения).
В косметологической практике обычно используются низкие дозы БТА (при коррекции морщин) или же инъекции проводятся с большими интервалами (при лечении гипергидроза), в связи с чем сероконверсия происходит крайне редко (0,28–0,46% пациентов). Очень важно отметить, что сероконверсия, как правило, не сопровождается утратой эффективности терапии.
Наиболее целесообразный и безопасный клинический подход, обеспечивающий профилактику образования блокирующих токсин антител, подразумевает использование минимальных доз, которые необходимы для обеспечения достаточного клинического эффекта, а также исключение «бустерных» инъекций.
В случаях развития вторичной неэффективности лечения возможно введение более высоких доз БТА или препаратов БТ типа В. При доказанной иммунорезистентности рекомендуется придерживаться тактики ожидания и наблюдения, поскольку со временем титры антител у большинства пациентов уменьшаются и возможно возобновление эффективной терапии. Тактика ведения пациентов с вторичной неэффективностью ботулинотерапии, предложенная Moore P. и Naumann M., представлена на рис. 6 [7].
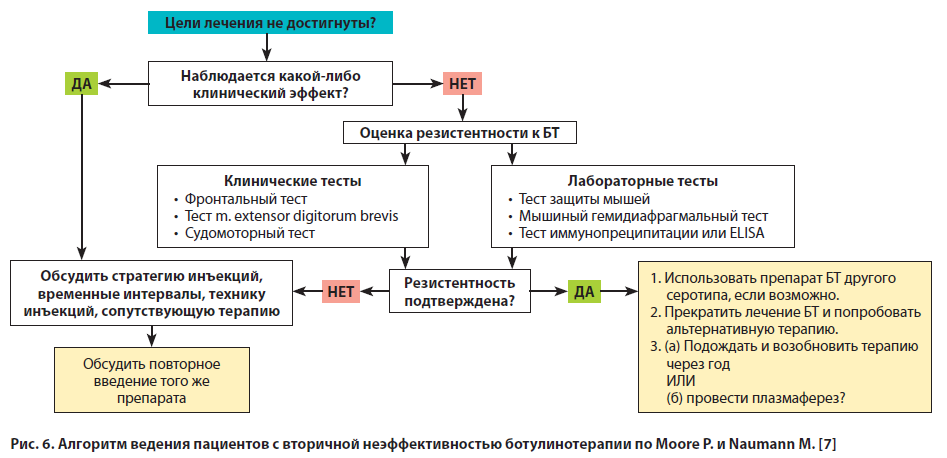
Следует помнить, что стратегия оптимизации ответа на лечение включает также фото- и видеодокументирование пациента до и после инъекции, уточнение локализации мышц-мишеней, тщательный подбор точек введения, выбор оптимальной дозы с учетом клинического ответа и переносимости терапии, а также периодическое проведение переоценки всех перечисленных показателей.
Еще раз подчеркнем, что формирование нейтрализующих антител — лишь один из многих возможных факторов, обусловливающих утрату клинического эффекта от введения БТ. На сегодняшний день проблема иммунорезистентности в косметологической практике является малозначимой. Следовательно, при анализе потенциальной неудачи лечения врач должен учитывать все возможные причины неэффективности терапии и владеть информацией о методах их предупреждения и преодоления.
Литература
1. Kukreja R., Chang T.W., Cai S. et al. Immunological characterization of the subunits of type A botulinum neurotoxin and diff erent components of its associated proteins. Toxicon. 2009; 53, 6: 616–624.
2. Frevert J., Dressler D. Complexing proteins in botulinum toxin type A drugs: a help or a hindrance? Biologics. 2010; 9, 4: 325–332.
3. Cai S., Sarkar H.K., Singh B.R. Enhancement of the endopeptidase activity of botulinum neurotoxin by its associated proteins and dithiothreitol. Biochemistry. 1999; 38, 21: 6903–6910.
4. Kukreja R.V., Singh B.R. Comparative role of neurotoxin-associated proteins in the structural stability and endopeptidase activity of botulinum neurotoxin complex types A and E. Biochemistry. 2007; 46, 49: 1416–1424.
5. Atassi M. Z. Basic immunological aspects of botulinum toxin therapy. Mov Disord. 2004; 19, Suppl 8: 68–84.
6. Dressler D. Clinical presentation and management of antibody-induced failure of botulinum toxin therapy. Mov Disord. 2004; 19, Suppl 8: 92–100.
7. Moore P., Naumann M. General and clinical aspects of treatment with botulinum toxin. In: Moore P., Naumann M., editors. Handbook of botulinum toxin treatment, Second ed. Malden, Mass: Blackwell Science; 2003: 28–75.
8. Naumann M., Carruthers A., Carruthers J. et al. Meta-analysis of neutralizing antibody conversion with onabotulinumtoxinA (BOTOX®) across multiple indications. Mov Disord. 2010; 25, 13: 2211–2218.
9. Goschel H., Wohlfarth K., Frevert J. et al. Botulinum A toxin therapy: neutralizing and nonneutralizing antibodies— therapeutic consequences. Exp Neurol 1997; 147, 1: 96–102.
10. Kessler K.R., Skutta M., Benecke R. Long-term treatment of cervical dystonia with botulinum toxin A: effi cacy, safety, and antibody frequency. German Dystonia Study Group. J Neurol. 1999; 246: 265–274.
11. Brin M.F., Comella C.L., Jankovic J. et al. Long-term treatment with botulinum toxin type A in cervical dystonia has low immunogenicity by mouse protection assay. Mov Disord. 2008; 23, 10: 1353–1360.
12. Müller K., Mix E., Adib Saberi F., Dressler D., Benecke R. Prevalence of neutralising antibodies in patients treated with botulinum toxin type A for spasticity. J Neural Transm. 2009; 116, 5: 579–585.
13. Koman L.A., Brashear A., Rosenfeld S. et al. Botulinum toxin type a neuromuscular blockade in the treatment of equinus foot deformity in cerebral palsy: a multicenter, open-label clinical trial. Pediatrics. 2001; 108, 5: 1062–1071.
14. Anyanwu B., Hanna P.A. and Jankovic J. Botulinum toxin: primary and secondary resistance. In: Ward A.B. and Barnes M.P., editors. Clinical uses of botulinum toxins. Cambridge University Press, New York; 2007: 45–57.
15. Kessler K.R., Benecke R. The EBD test — а clinical test for the detection of antibodies to botulinum toxin type А. Mov Disord. 1997; 12, 1: 95–99.
16. Gordon P.H., Gooch C.L., Greene P.E. Extensor digitorum brevis test and resistance to botulinum toxin type A. Muscle Nerve 2002; 26: 828–831.
17. Cordivari C., Misra V. P., Vincent A. et al. Secondary Nonresponsiveness to Botulinum Toxin A in Cervical Dystonia: The Role of Electromyogram-Guided Injections, Botulinum Toxin A Antibody Assay, and the Extensor Digitorum Brevis Test. Mov Disord. 2006; 21, 10: 1737–1741.
18. Birklein F., Erbguth F. Sudomotor testing discriminates between subjects with and without antibodies against botulinum toxin A — a preliminary observation. Mov Disord. 2000;15, 1: 146–149.
19. Lawrence I., Moy R. An evaluation of neutralizing antibody induction during treatment of glabellar lines with a new US formulation of botulinum neurotoxin type A. Aesthet Surg J. 2009; 29, Suppl 6: 66–71.
20. Hanna P.A., Jankovic J., Vincent A. Comparison of mouse bioassay and immunoprecipitation assay for botulinum toxin antibodies. J Neurol Neurosurg Psychiatry. 1999; 66, 5: 612–616.
21. Dressler D., Dirnberger G. Botulinum Toxin Antibody Testing: Comparison between the Immunoprecipitation Assay and the Mouse Diaphragm Assay. Eur Neurol. 2001; 45, 4: 257–260.
22. Dressler D., Lange M., Bigalke H. Mouse diaphragm assay for detection of antibodies against botulinum toxin type B. Mov Disord. 2005; 20, 12: 1617–1619.
23. Sesardic D., Jones R.G., Leung T. et al. Detection of antibodies against botulinum toxins. Mov Disord. 2004; 19, Suppl 8: 85–91.
24. Dressler D., Münchau A., Bhatia K.P. et al. Antibody-Induced Botulinum Toxin Therapy Failure: Can It Be Overcome by Increased Botulinum Toxin Doses? Eur Neurol. 2002; 47, 2: 118–121.
25. Siegel L.S. Human immune response to botulinum реntavalent (ABCDE) toxoid determined by а neutralization test and by an enzyme-linked immunosorbent assay. J Clin. Microbiol. 1988; 26, 11: 2351–2356.
26. Dressler D., Bigalke H. Botulinum toxin antibody type A titres after cessation of botulinum toxin therapy. Mov Disord. 2002; 17, 1: 170–173.
27. Lee S.K. Antibody-induced failure of botulinum toxin type A therapy in a patient with masseteric hypertrophy. Dermatol Surg. 2007; 33, 1: 105–110.
28. Dressler D., Wohlfahrt K., Meyer-Rogge E. et al. Antibody-induced failure of botulinum toxin a therapy in cosmetic indications. Dermatol Surg. 2010; 36, Suppl 4: 2182–2187.
29. Dressler D., Hallett M. Immunological aspects of Botox, Dysport and Myobloc/NeuroBloc. Eur J Neurol. 2006; 13, Suppl 1: 11–15.
30. Rollnik J.D., Wohlfarth K., Dengler R., Bigalke H. Neutralizing botulinum toxin type А antibodies: clinical observations in patients with cervical dystonia. Neurol Clin Neurophysiol. 2001; 3: 2–4.
31. Dressler D. Managing patients with botulinum toxin antibodies. International Conference 1999: basic and therapeutic aspects of botulinum and tetanus toxin. Orlando, FL., November 16–18, 1999: 32.
32. Dressler D., Zettl U., Bigalke H., Benecke R. Can intravenous immunoglobulin improve antibody mediated botulinum toxin therapy failure. Mov. Disord. 2000; 15, 6: 1279–1281.
33. Dressler D. Clinical features of antibody-induced complete secondary failure of botulinum toxin therapy. Eur Neurol. 2002; 48, 1: 26–29.
34. Dressler D. [Clinical relevance of botulinum toxin antibodies]. Nervenarzt. 2008; 79, Suppl 1: 36–40 (PubMed).
35. Dressler D., Saberi F.A. New formulation of Botox: complete antibodyinduced treatment failure in cervical dystonia. BMJ Case Rep. 2009; pii: bcr08.2008.0611.
36. Lange O., Bigalke H., Dengler R. et al. Neutralizing antibodies and secondary therapy failure after treatment with botulinum toxin type A: much ado about nothing? Clin Neuropharmacol. 2009; 32, 4:213–218.
37. Borodic G., Johnson E., Goodnough M., Schantz E. Botulinum toxin therapy, immunologic resistance, and problems with available materials. Neurology. 1996; 46, 1: 26–29.
38. Jankovic J., Vuong K.D., Ahsan J. Comparison of effi cacy and immunogenicity of original versus current botulinum toxin in cervical dystonia. Neurology. 2003; 60, 7: 1186–1188.
39. Aoki K.R., Ranoux D., Wissel J. Using translational medicine to understand clinical diff erences between botulinum toxin formulations. Eur J Neurol. 2006; 13, Suppl 4: 10–19.
40. Lee J.C., Yokota K., Arimitsu H. et al. Production of anti-neurotoxin antibody is enhanced by two subcomponents, HA1 and HA3b, of Clostridium botulinum type B 16S toxin-haemagglutinin. Microbiology.2005; 151, 11: 3739–3747.
41. Frevert J. Xeomin: an innovative new botulinum toxin type A. Eur J Neurol. 2009; 16, Suppl 2: 11–13.