О. Б. Борзых, Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого, Российская Федерация
Н. А. Шнайдер, Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого, Российская Федерация, Национальный медицинский исследовательский центр психиатрии и неврологии им. В. М. Бехтерева, Санкт-Петербург, Российская Федерация
Е. И. Карпова, Российский национальный исследовательский медицинский университет им. Н. И. Пирогова, Москва, Российская Федерация
М. М. Петрова, Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого, Российская Федерация
О. М. Демина, Российский национальный исследовательский медицинский университет им. Н. И. Пирогова, Москва, Российская Федерация
Р. Ф. Насырова Национальный медицинский исследовательский центр психиатрии и неврологии им. В. М. Бехтерева, Санкт-Петербург, Российская Федерация, Казанский федеральный университет, Российская Федерация
Одна из важных функций кожи – социальная. Она направлена на отображение информации о здоровье и возрасте человека. В свою очередь, состояние кожи зависит от состояния всех ее клеточных и внеклеточных компонентов [1]. Важнейшим внеклеточным элементом кожи является коллаген, составляющий до 70 % всех белков дермы [2]. Имея полноценную структуру коллагеновых волокон, наша кожа может отображать состояние молодости организма.
Во врачебной косметологии существует огромный выбор различных методик, направленных на улучшение здоровья кожи и сглаживание проявлений возраста. Однако достаточно часто можно отметить то, что, применяя одни и те же процедуры у разных пациентов, мы можем получать разные результаты. Это может зависеть от разных факторов, как внешних, так и внутренних [3, 4]. К таким факторам относятся и генетические особенности, в том числе обмена коллагена [5, 6]. Знания особенностей обмена коллагена в коже могут помочь в выборе наиболее эффективных процедур во врачебной косметологии и сделать шаг в сторону персонализированной и предиктивной медицины в рассматриваемой области медицинской науки [7].
Функция коллагена в коже. За механические свойства кожи, в основном, отвечает дерма, а за прочность – сеть коллагеновых волокон [8]. Биомеханические свойства кожи зависят от возраста пациента, толщины кожи, наполненности гиалуроновой кислотой и водой, а также от извитости коллагеновых волокон [9].
В коже находятся несколько типов коллагенов, которые имеют не только механическую функцию (поддержки клеток и тканей), но функцию взаимодействия с клетками и влияния на различные клеточные процессы (миграция, пролиферация, дифференцировка) и процессы регенерации соединительной ткани [10]. По сути, коллагеновые волокна регулируют пролиферацию, дифференцировку, миграцию и апоптоз клеток через предоставление клеткам топографических, биохимических и механических сигналов [11, 12]. Конечно, одна из главных функций коллагена – механическая. Так, коллагеновые волокна обладают отличительной нелинейной эластичностью – усиление жесткости при деформации [13]. Сама механическая прочность фибриллярных коллагенов зависит от поперечных связей между фибриллами, которые образуются в процессе ферментативного действия членов семейства лизиоксидазы (LOX) [14–16].
Особенности структуры коллагена. В организме человека коллаген участвует в формировании волокнистых, микроволокнистых и других структур межклеточного матрикса и базальных мембран. Известно более 28 видов коллагенов и более 40 генов, кодирующих коллаген [17]. Все коллагены имеют три левозакрученные спирали, свернутые в правозакрученную суперспираль. Основная структурная единица коллагена – тропоколлаген имеет молекулярную массу 285 кДа [18]. Коллагенам при их открытии в тканях животных на уровне белка были присвоены римские цифры. Спираль коллагена состоит из полипептидной цепи, называемой α-цепью. Для систематизации множества генов коллагена была разработана номенклатура, указывающая конкретную α-цепь на основе типа коллагена, в которой она находится. Например, для коллагена I типа существуют 2 разные полипептидные цепи, и они будут указываться как α1(I)- и α2(I)-цепи, кодируемые генами COL1A1 и COL1A2 соответственно [19, 20]. Молекула коллагена может состоять из трех цепей с одинаковой аминокислотной последовательностью (α1) – она носит название «гомомерная», а может быть две цепи с одинаковой последовательностью (α1) и одной с отличной последовательностью (α2) или все три с разной последовательностью (α1, α2, α3) – такие молекулы называются «гетеромерные». Более того, некоторые виды коллагена могут быть и гомомерными, и гетеромерными (например, коллаген I типа), а также некоторые виды могут содержать комбинации из 6 цепей (например, коллаген IV типа). Регуляция «складывания» α-цепей в гетеромономерную или гомомерную суперспираль осуществляется за счет С-концевого пептида [21].
Основные типы коллагеновых волокон в дерме. Известно, что дерма состоит из 2 слоев, отличающихся по строению и функционально. Так, сосочковый слой кожи играет ключевую роль в трофике эпидермиса и включает множество клеточных дифферонов с преобладанием аморфного вещества над волокнистым во внеклеточном матриксе [2, 22]. Сетчатый же слой дермы играет ключевую роль в формировании механических свойств кожи, в нем преобладает волокнистая структура, представленная толстыми пучками коллагеновых волокон, расположенных в разных направлениях. В норме коллагеновые волокна в сетчатом слое кожи более тонкие, имеют волнообразную и упорядоченную структуру, а в сосочковом слое – более толстые фибриллы, располагающиеся более хаотично, формирующие рыхлый слой [23]. При патологии (в рубцах) отмечено параллельное расположение коллагеновых волокон, при этом в келоидных рубцах более толстые молекулы коллагена. При старении накапливается балластный (недеградируемый) коллаген со сглаживанием границы дермально-эпидермального соединения [22, 23].
Все коллагены, в зависимости от структуры макромолекулы и надмолекулярных образований, подразделяются на фибриллярные (образующие волокна) и нефибриллярные семейства.
Разные типы коллагена, представленного в коже, отличаются по аминокислотной последовательности молекулы тропоколлагена и посттрансляционным модификациям (по степени гидроксилирования и гликолизирования пролина и лизина). Основные типы коллагена, представленного в коже, это фибриллярные коллагены I, III, V типов, имеющие корзиночновидные переплетения в коже. При этом коллагены I и III типов относятся к подсемейству интерстициальных коллагенов [24]. Другие типы коллагеновых волокон представлены в меньших количествах, но значимость их подтверждена заболеваниями, ассоциированными с мутациями соответствующих им генов (табл. 1). Фибриллы обеспечивают возможность для прикрепления различным макромолекулам (протеогликаны, фибронектин, интегрины и другие).
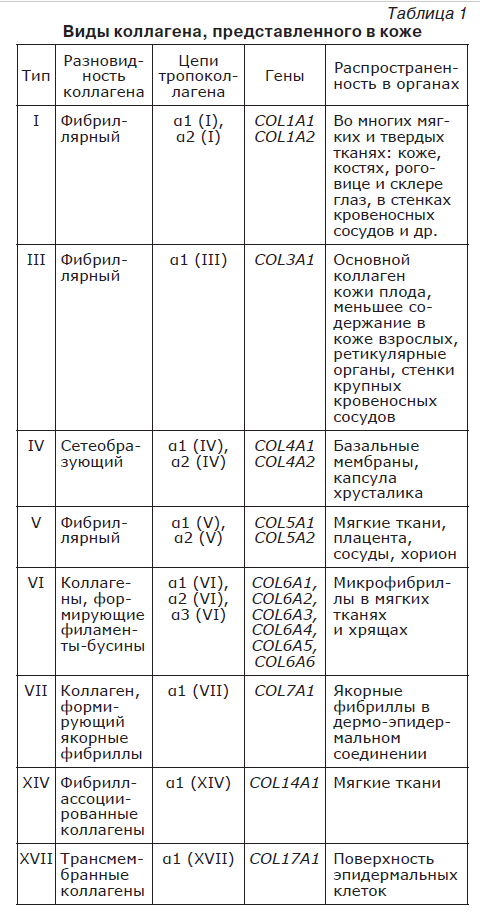
Основным структурным белком костей, кожи, связок и других соединительных тканей является коллаген I типа (он составляет 80–90 % от общего коллагена кожи), состоящий чаще всего из двух α1-цепей и одной α2-цепи. Это самый «древний» коллаген, обладающий наибольшей прочностью. Основные биомеханические свойства кожи обеспечивает коллаген I типа, а при нарушении его синтеза кожа становится менее прочной, дряблой, проявляется гравитационный птоз тканей лица.
Коллаген III типа (составляет от 8 до 12 % коллагена кожи) преобладает в коже в перинатальном возрасте, имеет более тонкие волокна и оплетает волокна коллагена I типа в коже взрослого человека, а также может образовываться на первом этапе регенерации после повреждения, замещаясь волокнами коллагена I типа. Коллагеновые волокна III типа состоят из трех α1-цепей и вместе с аморфным веществом формируют ретикулин (ретикулярную ткань), являющуюся основой для некоторых мягких тканей. Так, волокна коллагена III типа выступают в качестве основного структурного компонента полых органов (крупные кровеносные сосуды, матка, кишечник), которые должны выдерживать растяжение. Молекула коллагена III типа меньше по диаметру в сравнении с коллагеном I типа, а при наличии коллагенов I и III типов в одной и той же фибрилле, коллаген III типа регулирует диаметр волокна. Коллаген III типа является сигнальной молекулой, обеспечивающей заживление ран, за счет участия в клеточной адгезии, миграции, пролиферации и дифференцировки через рецепторы
на поверхности клеток (интегрины). Исследования показали регулирующую роль коллагена III типа в обмене коллагена I типа. Так, при дефиците коллагена III типа была показана большая дифференцировка фибробластов в миофибробласты, контрактура раны и аномальный фибриллогенез коллагена I типа [25].
Биохимический состав коллагена I и III типов радикально не отличается, но присутствие коллагена III типа во время физиологических процессов может иметь решающее действие. Коллаген III типа активно экспрессируется во время развития и заживления ран. Коллаген III типа может коэкспрессироваться с волокнами коллагена I типа, с образованием гетеротипических волокон, регулируя диаметр фибрилл, и влияет на механические свойства кожи [26].
Коллагеновые волокна V типа (составляет менее 5 % коллагена кожи) находятся в меньшем количестве, состоят из одной цепей α1 (V) и двух α2 (V) цепи. Также встречаются волокна, состоящие только из трех α1 (V) цепей. Ранее считалось, что основная функция коллагена V типа – участие в формировании базальной мембраны и стенки сосудов. Однако в последние годы показана его роль в формировании растущих фибрилл более многочисленных коллагеновых волокон I типа [27], поэтому коллаген V типа может быть отнесен к регуляторным коллагенам, образующим фибриллы.
Нефибриллярные коллагены (IV, VI–VIII, XIV типы) не способны образовывать классические фибриллы. Они могут составлять ретикулярные сети, соединять клетки с базальной мембраной, помогать в организации других коллагеновых волокон. Коллагеновые волокна IV типа принимают участие в формировании базальной мембраны, а также находятся в придатках кожи, стенках кровеносных сосудов [28], он образует плоскую сеть за счет связывания С- и N-концов с образованием сначала димеров, затем тетрамеров. Отличительной особенностью коллагена IV типа является повышенное гликозилирование цепей [29].
Коллаген VI типа обладает способностью ингибировать апоптоз фибробластов и может долго определяться в заживающей ране. В якорных пластинках дермо-эпидермального соединения находятся коллагеновые волокна VII типа [30], крайне важного компонента экстрацеллюлярного матрикса, удерживающего структурную целостность кожи [31]. Коллаген VII типа связывает между собой слои дермы и с базальной мембраной. При заживлении раны коллаген VII типа может поддерживать миграцию дермальных фибробластов, регулировать экспрессию цитокинов в макрофагах. В исследованиях при введении коллагена VII типа в раны происходило снижение экспрессии фиброгенных TGF-β2 и αSMA, при увеличении экспрессии антифиброгенного TGF-β3, что представляет интерес для контроля фиброзирования в процессе заживления раны [25]. Коллаген XIV типа в заживающей ране способен снижать пролиферацию и дифференцировку дермальных фибробластов, сохраняя нормальную жизнеспособность клеток.
Образование коллагенового волокна. Синтез коллагеновых волокон в коже осуществляется дермальными фибробластами, активированными TGFβ (фактор, регулирующий экспрессию, отложение и обмен белков). Дермальные фибробласты способны синтезировать волокна коллагена в большей мере, чем в других тканях, так как коллаген имеет чрезвычайно важную структурную функцию в коже [32]. При этом важным условием инициации синтеза коллагена является достаточный уровень механического натяжения на фибробластах. Фибробласты также ответственны за деградацию волокнистых и аморфных белков межклеточного вещества, они осуществляют свою функцию, взаимодействуя с окружающей средой.
Образование коллагеновых волокон с дальнейшим объединением их в пучки фибрилл называется фибриллогенезом. Молекула коллагена очень чувствительна к однонуклеотидным вариантам (ОНВ) и мутациям в генах, отвечающих за его синтез и сборку (фолдинг). В результате мутационных и эпигенетических процессов формируется коллаген с нарушенными биомеханическими свойствами [33].
Синтез коллагеновых волокон – это сложный процесс, включающий несколько стадий, начинающийся в фибробласте (сборка полипептидной цепи на рибосомах фибробласта) и продолжающийся в межклеточном веществе. Сборка молекулы коллагена включает такие шаги, как ассоциацию, сворачивание, секрецию, обработку проколлагена и перекрестное сшивание молекул [14].
Синтез молекулы коллагена начинается с образования предшественника – проколлагена, состоящего из про-α-цепей. Сборка и правильная укладка проколлагена происходит внутри эндоплазматического ретикулума [34]. Каждая цепь сворачивается в левозакрученную спираль, затем 3 α-цепи сходятся в С-концах, с образованием дисульфидных связей. Структура из 3 цепей стабилизируется и сворачивается в правую тройную суперспираль. Направление сшивки происходит от С-конца к N-концу подобно застежки молнии [14]. Соединение трех α-цепей происходит за счет соединения С-концевых пропептидов, боковая ассоциация происходит в аппарате Гольджи и затем тройные спиральные молекулы секретируются из клетки, а N- и С-концевые пропептиды удаляются [35].
После образования суперспирали протеинкиназы удаляют С- и амино (N)-концевые большие глобулярные домены, между некоторыми остатками лизина и гидроксилизина образуются поперечные связи и таким образом формируется трехспиральный мономер коллагена – тропоколлаген [36]. Молекула тропоколлагена транспортируется в сеть Гольджи, где она упаковывается в специальные секреторные везикулы, после чего секретируется во внеклеточную среду.
В межклеточном веществе получается тропоколлаген с короткими N- и С-концевыми телопептидами и центральным трехспиральным доменом. N-концевой пропептид из молекулы проколлагенов I и III типов удаляет дезинтегрин и металлопротеаза с тромбоспондиновыми мотивами (ADAMTS) [37, 38]. С-концевой пропептид отщепляет проколлаген С-протеиназа-2/костный морфогенетический белок-1. Также отщепление N- и C-пропептидов коллагена III типа возможно мепринами α и β, таким образом высвобождается зрелый белок, который
впоследствии собирается в фибриллы.
Тропоколлаген представляет собой левозакрученную спираль, состоящую из трех α-цепей. При этом один виток спирали состоит из триады аминокислот (называемой коллагеновым доменом) [39], в которых третья аминокислота всегда глицин, вторая или первая – пролин или гидроксипролин, вместо пролина и гидроксипролина может быть любая [40]. Пролин или гидроксипролин обеспечивают стабильность третичной структуры молекулы коллагена. Таким образом, глицин занимает около трети всех аминокислот, а пролин и гидроксипролин вместе – около 23 %. При этом из всех запасов гидроксипролина организма около 99,8 % содержится в коллагене [41].
Важность пролина в синтезе коллагена доказывают исследования нарушения функции пролидазы (фермент, освобождающий пролин), которое имеет место при ряде дерматологических симптомов, связанных с дефицитом пролина [42]. Эндогенного синтеза пролина может быть недостаточно для обеспечения всех потребностей при синтезе коллагена. Для синтеза коллагенового волокна важно достаточное количество специфичных коллагену аминокислот, поступающих с пищей. А при использовании мезотерапии (или биоревитализации) с целью повышения качества и количества коллагеновых волокон в коже важно достаточное содержание специфичных аминокислот в используемом препарате. Организм также способен синтезировать пролин из аргинина, глутамина и глутамата. Так, исследования показали, что добавление аргинина и орнитина увеличивают синтез и отложение коллагена [43].
Протекание биохимических реакций синтеза коллагеновых волокон требует достаточного обеспечения витаминами и минералами, участвующими на различных посттрансляционных этапах фибриллогенеза. Пострансляционные (т. е. после образования полипептидной цепи на рибосомах) изменения заключаются в отщеплении концевых полипептидов проколлагена N-, C-протеинкиназами с образованием третичной структуры белка [44]. По сути, посттрансляционные модификации (гидроксилирование, гликолизирование, фосфорилирование) дополняют «вторичный слой информации» к аминокислотной последовательности, обеспечивая тканеспецифичность коллагенов [45].
Одна из важный посттрансляционных реакций, влияющих на характеристику коллагенового волокна, – реакция гидроксилирования пролильных и лизильных остатков. При этом на каждом этапе требуются свои специфические ферменты, например: пролингидроксилаза необходима для гидроксилирования пролина. В структуре фермента пролингидроксилазы в центре находится железо, меняющее свою валентность, и вслед за этим меняется активность фермента. Окисление в двухвалентное железо обеспечивается витамином С и активностью пролингидроксилазы. При этом лизилоксилаза требует присутствия ионов Cu2+, поэтому при дефиците меди может нарушаться сшивка молекул коллагена без нарушения образования коллагеновых волокон [43]. Окисление остатков лизина необходимо для образования поперечный связей, стабилизирующих фибриллы и коллагеновые волокна [46]. Примером нарушения реакций гидроксилирования является цинга, когда в условиях дефицита витамина С происходит нарушение образования двухвалентного железа, вслед за
ним – нарушение активности гидроксилаз и, как следствие, образование «рыхлого» коллагена [47]. Также дефицит витамина С может оказывать ингибирующее влияние на синтез коллагена и протеогликанов через инсулиноподобный фактор роста 1 [48].
Другие посттрансляционные реакции включают N- и О-связанное гликолизирование, дисульфидное связывание и пролил-цис-транс-изомеризацию [14]. Так, после гидроксилирования пролина начинается гликолизирование селективных остатков 5-гидроксилизина. После гликолизирования происходит изомеризация пролина и 4-гидрокси-L-пролина из цис- в транс-форму.
В межклеточном веществе происходит формирование третичной структуры – спонтанное объединение молекул коллагена в более крупные молекулы (шестиугольной или псевдошестиугольной конструкции). Этот процесс происходит с помощью белков и гликопротеинов нескольких классов, включая другие виды коллагена. Фибробласты за счет молекул клеточной адгезии и дендритных расширений взаимодействуют с фибриллами коллагена и способствуют формированию сетчатой структуры из коллагеновых молекул, после чего фибриллы стабилизируются с помощью нековалентных взаимодействий [49]. Молекулы тропоколлагена собираются в микрофибриллы (по 5 штук), затем в фибриллы и коллагеновые волокна [50].
Регуляция биосинтеза коллагена. В среднем физиологическое обновление коллагеновых волокон в коже происходит за 40–60 дней, что зависит от слоя (скорость обновления выше в сосочковом слое, чем в сетчатом) и состояния межклеточного матрикса (концентрация протеогликанов и витаминов, уровня кислотности). Угнетение синтеза коллагеновых волокон происходит при старении, а также под действием факторов внешней среды, в частности под действием УФ-излучения угнетается экспрессия генов коллагенов I и III типов и усиливается протеолитическая активность ферментов.
Экспрессия гена, кодирующего коллаген, и сборка белковой молекулы регулируются на всех стадиях: от уровня ядерной дезоксирибонуклеиновой кислоты (ДНК) с изменением степени упаковки хроматина до модификации стабильности матричной рибонуклеиновой кислоты (мРНК), направляющейся в рибосому для сборки полипептидной цепи [43]. Интенсивность синтеза регулируется в зависимости от потребностей организма. При этом в регуляции принимают участие индукторы и ингибиторы синтеза коллагеновых волокон (табл. 2).
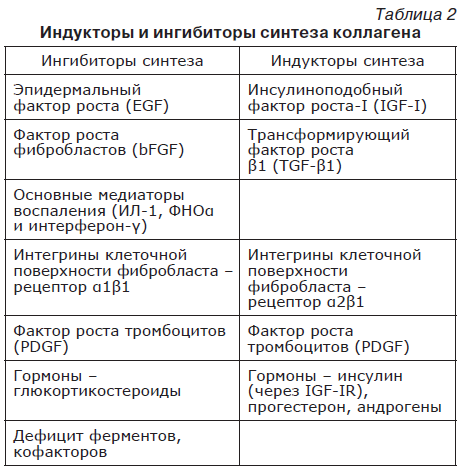
Ингибирование транскрипции генов коллагена может осуществляться эпидермальным фактором роста (EGF). Кроме транскрипции генов коллагена, он может снижать стабильность мРНК и стимулировать экспрессию коллагеназы для усиления протеолиза. Другой ингибитор транскрипции – фактор роста фибробластов (bFGF). Фактор роста тромбоцитов (PDGF) может оказывать индукционное и тормозящее действие на синтез коллагена в зависимости от изоформы данного белка.
Основные медиаторы воспаления (цитокины) – ИЛ-1, ФНОα и интерферон-γ – через гетеродимер р50/р65 фактора транскрипции NF-kB ингибируют транскрипцию генов обеих цепей коллагена I типа.
Взаимодействие фибробластов с коллагеновым внеклеточным матриксом регулирует синтез проколлагена I типа. Взаимодействие пептидов коллагена с интегринами клеточной поверхности индуцирует синтез проколлагена внутри фибробластов. Рецептор α2β1 стимулирует транскрипцию гена коллагена I типа, а сигнал от рецептора α1β1 – ингибируется по принципу обратной связи. В присутствии деградированных коллагеновых молекул этот механизм нарушается. Показано, что в фотоповрежденной коже происходит нарушение передачи сигнала от пептидов коллагена к интегринам клетки, ведущее к снижению синтеза проколлагена. Происходит это по причине нахождения большого количества фрагментов коллагена, не взаимодействующих с интегринами клеток. При этом изъятые фибробласты из фотоповрежденной кожи обладают схожей синтетической активностью с фибробластами из фотонеповрежденной кожи [51].
Сильными индукторами биосинтеза коллагена являются инсулиноподобный фактор роста-I (IGF-I) и трансформирующий фактор роста β1 (TGF-β1) [52, 53]. IGF-I наиболее активен в отношении синтеза коллагена, а TGF-β1 модулирует и другие ключевые компоненты межклеточного вещества, такие как фибриллярные коллагены [54]. В фибробластах кожи TGF-β регулирует продукцию и деградацию коллагена, обеспечивая гомеостаз, сначала он связывается с рецептором TGF-β типа II (TβRII), фосфорилирующий рецептор I типа (TβRI). Таким образом происходит активизация образования гетеромерных комплексов Smad, перемещающихся в ядро и активизирующих гены-мишени TGF-β, включая гены коллагена, фибронектина, декорина и версикана. Активизация генов матриксных металлопротеаз происходит при снижении активности комплексом Smad, а ингибиторов матриксных металлопротеаз – при повышении [55].
Контроль осуществляется на всех этапах синтеза коллагена за счет регуляции действия ферментов, активность которых может зависеть от содержания различных кофакторов, таких как железо, аскорбиновая кислота, медь, кальций, магний и др. Так, синтез протеогликанов фибробластами является магний-зависимым процессом, а на фоне дефицита магния происходит усиление деградации коллагеновых волокон и поперечных сшивок в них [56]. Некоторые неферментативные модификации, такие как гликирование, окисление и хлорирование, могут быть внеклеточными регуляторными механизмами, влияющими на архитектуру и стабильность тканей [46].
Гормональная регуляция синтеза коллагена возможна через инсулин (через IGF-IR), прогестерон и андрогены – стимулирующие биосинтез и через глюкокортикоиды – тормозящие биосинтез.
Самосборка коллагена в фибриллярные сети кодируется в самой молекуле коллагена. Таким образом, в физиологических условиях коллаген спонтанно собирается в упорядоченные фибриллы, которые, разветвляясь и сшиваясь, собираются в трехмерную сеть [13]. Решающее значение для трехмерной ориентации сети имеют остатки глицина.
Заключение. Синтез коллагена – это сложный многоступенчатый процесс. Организму нужна слаженная работа всех ключевых агентов в процессе фибриллогенеза и достаточность всех необходимых нутриентов для протекания биохимических процессов.
Любой сбой может приводить к снижению синтеза и/или сборки коллагеновых волокон в коже с нарушенными характеристиками.
Физиологическое снижение синтеза происходит при старении вследствие естественных механизмов. Однако если на приеме у врача косметолога находится пациент со снижением тонуса кожи, несоразмерным возрастным изменениям, стоит задуматься о нарушении механизма коллагенообразования. Сбой синтеза и фолдинга коллагена в коже может быть обусловлен разными генетическими и эпигенетическими факторами.
Реализация Концепции персонализированной медицины обеспечивает развитие индивидуального подхода к пациенту в определении рисков и ранней диагностике, предупреждению заболевания, лечению с учетом индивидуальных особенностей на основании генетических и других биомаркеров [57].
Авторы заявляют об отсутствии конфликта интересов.
Литература/References
1. Farage M. A., Miller K. W., Elsner P., Maibach H. I. Characteristic of aging skin. Adv. Wound Care (New Rochelle). 2013;2(1):5-10. https://doi.org/10.1089/wound.2011.0356
2. Burgeson R. E. The collagens of skin. Curr. Probl. Dermatol. 1987;17:61-75.
3. Arai K. Y., Hara T., Nagatsuka T., Kudo C., Tsuchiya S. [et al.]. Postnatal changes and sexual dimorphism in collagen expression in mouse skin. PLoS One. 2017;12(5):e0177534. https://doi.org/10.1371/journal.pone.0177534
4. Arseni L., Lombardi A., Orioli D. From Structure to Phenotype: Impact of Collagen Alterations on Human Health. Int. J. Mol. Sci. 2018;19(5):1407. https://doi.org/10.3390/ijms19051407
5. Tonniges J. R., Albert B., Calomeni E. P., Roy S., Lee J. [et al.]. Collagen Fibril Ultrastructure in Mice Lacking Discoidin Domain Receptor 1. Microsc. Microanal. 2016;22(3):599-611. https://doi.org/10.1017/S1431927616000787
6. Luczynski M. T., Harrison P. T., Lima N., Krasny L.,Paul A., Huang P. H. Spatial localisation of Discoidin Domain Receptor 2 (DDR2) signalling is dependent on its collagen binding and kinase activity. Biochem. Biophys. Res. Commun. 2018;501(1):124-130. https://doi.org/10.1016/j.bbrc.2018.04.191
7. Ahmed T., Nash A., Clark K. E., Ghibaudo M., de Leeuw N. H. [et al.]. Combining nano-physical and computational investigations to understand the nature of «aging» in dermal collagen. Int. J. Nanomedicine. 2017;12:3303-3314. https://doi.org/10.2147/IJN.S121400
8. Pawlaczyk M., Lelonkiewicz M., Wieczorowski M. Age-dependent biomechanical properties of the skin. Poster Der. Alergol. 2013;30(5):302-306. https://doi.org/10.5114/pdia.2013.38359
9. Solano F. Metabolism and Functions of Amino Acids in the Skin. Adv. Exp. Med. Biol. 2020;1265:187-199. https://doi.org/10.1007/978-3-030-45328-2_11
10. Gkogkolou P., Böhm M. Advanced glycation end products: Key players in skin aging? Dermatoendocrinol. 2012;4(3):259-270. https://doi.org/10.4161/derm.22028
11. Wahyudi H., Reynolds A. A., Li Y., Owen S. C., Yu S. M. Targeting collagen for diagnostic imaging and therapeutic delivery. J. Control Release. 2016;240:323-331. https://doi.org/10.1016/j.jconrel.2016.01.007
12. Ozcelikkale A., Dutton J. C., Grinnell F., Han B. Effects of dynamic matrix remodelling on en masse migration of fibroblasts on collagen matrices. J. R. Soc. Interface. 2017;14(135):20170287. https://doi.org/10.1098/rsif.2017.0287
13. Jansen K. A., Licup A. J., Sharma A., Rens R., MacKintosh F. C., Koenderink G. H. The Role of Network Architecture in Collagen Mechanics. Biophys. J. 2018;114(11):2665-2678. https://doi.org/10.1016/j.bpj.2018.04.043
14. Rodriguez-Pascual F., Slatter D. A. Collagen cross-linking: insights on the evolution of metazoan extracellular matrix. Sci. Rep. 2016;6:37374. https://doi.org/10.1038/srep37374
15. Jones M. G., Andriotis O. G., Roberts J. J., Lunn K., Tear V. J. [et al.]. Nanoscale dysregulation of collagen structure-function disrupts mechano-homeostasis and mediates pulmonary fibrosis. Elife. 2018;7:e36354. https://doi.org/10.7554/eLife.36354
16. Argyropoulos A. J., Robichaud P., Balimunkwe R. M., Fisher G. J., Hammerberg C. [et al.]. Alterations of Dermal Connective Tissue Collagen in Diabetes: Molecular Basis of Aged-Appearing Skin. PLoS One. 2016;11(4):e0153806. https://doi.org/10.1371/journal.pone.0153806
17. Walters B. D., Stegemann J. P. Strategies for directing the structure and function of three-dimensional collagen biomaterials across length scales. Acta Biomater. 2014;10(4):1488-1501. https://doi.org/10.1016/j.actbio.2013.08.038
18. Saunders J. T., Schwarzbauer J. E. Fibronectin matrix as a scaffold for procollagen proteinase binding and collagen processing. Mol. Biol. Cell. 2019;30(17):2218-2226. https://doi.org/10.1091/mbc.E19-03-0140
19. Kadler K. E. Fell Muir Lecture: Collagen fibril formation in vitro and in vivo. Int. J. Exp. Pathol. 2017;98(1):4-16. https://doi.org/10.1111/iep.12224
20. Gistelinck C., Gioia R., Gagliardi A., Tonelli F., Marchese L. [et al.]. Zebrafish Collagen Type I: Molecular and Biochemical Characterization of the Major Structural Protein in Bone and Skin. Sci. Rep. 2016;6:21540. https://doi.org/10.1038/srep21540
21. Bourhis J. M., Mariano N., Zhao Y., Harlos K., Exposito J. Y. [et al.]. Structural basis of fibrillar collagen trimerization and related genetic disorders. Nat. Struct. Mol. Biol. 2012;19(10):1031-1036. https://doi.org/10.1038/nsmb.2389
22. Bonté F., Girard D., Archambault J. C., Desmoulière A. Skin Changes During Ageing. Subcell. Biochem. 2019;91:249-280. https://doi.org/10.1007/978-981-13-3681-2_10
23. Boismal F., Serror K., Dobos G., Zuelgaray E., Bensussan A., Michel L. Skin aging: Pathophysiology and innovative therapies. Medicine Sciences (Paris). 2020;36(12):1163-1172. https://doi.org/10.1051/medsci/2020232
24. Hoop C. L., Zhu J., Nunes A. M., Case D. A., Baum J. Revealing Accessibility of Cryptic Protein Binding Sites within the Functional Collagen Fibril. Biomolecules. 2017;7(4):76. https://doi.org/10.3390/biom7040076
25. Tracy L. E., Minasian R. A., Caterson E. J. Extracellular Matrix and Dermal Fibroblast Function in the Healing Wound. Adv. Wound Care (New Rochelle). 2016;5(3):119-136. https://doi.org/10.1089/wound.2014.0561
26. Asgari M., Latifi N., Heris H. K., Vali H., Mongeau L. In vitro fibrillogenesis of tropocollagen type III in collagen type I affects its relative fibrillar topology and mechanics. Sci. Rep. 2017;7(1):1392. https://doi.org/10.1038/s41598-017-01476-y
27. Park A. C., Phan N., Massoudi D., Liu Z., Kernien J. F. [et al.]. Deficits in Col5a2 Expression Result in Novel Skin and Adipose Abnormalities and Predisposition to Aortic Aneurysms and Dissections. Am. J. Pathol. 2017;187(10):2300-2311. https://doi.org/10.1016/j.ajpath.2017.06.006
28. Godwin A. R. F., Starborg T., Sherratt M. J., Roseman A. M., Baldock C. Defining the hierarchical organisation of collagen VI microfibrils at nanometre to micrometre length scales. Acta Biomater. 2017;52:21-32. https://doi.org/10.1016/j.actbio.2016.12.023
29. Boudko S. P., Danylevych N., Hudson B. G., Pedchenko V. K. Basement membrane collagen IV: Isolation of functional domains. Methods Cell. Biol. 2018;143:171-185. https://doi.org/10.1016/bs.mcb.2017.08.010
30. Wullink B., Pas H. H., Van der Worp R. J., Kuijer R., Los L. I. Type VII Collagen Expression in the Human Vitreoretinal Interface, Corpora Amylacea and Inner Retinal Layers. PLoS One. 2015;10(12):e0145502. https://doi.org/10.1371/journal.pone.0145502
31. Gebauer J. M., Flachsenberg F., Windler C., Richer B., Baumann U. [et al.]. Structural and biophysical characterization of the type VII collagen vWFA2 subdomain leads to identification of two binding sites. FEBS Open Bio. 2020;10(4):580-592. https://doi.org/10.1002/2211-5463.12807
32. Sanchez A., Blanco M., Correa B., Perez-Martin R. I., Sotelo C. G. Effect of Fish Collagen Hydrolysates on Type I Collagen mRNA Levels of Human Dermal Fibroblast Culture. Mar. Drugs. 2018;16(5):144. https://doi.org/10.3390/md16050144
33. Geister K. A., Lopez-Jimenez A. J., Houghtaling S., Ho T. H., Vanacore R., Beier D. R. Loss of function of Colgalt1 disrupts collagen post-translational modification and causes musculoskeletal defects. Dis. Model. Mech. 2019;12(6):dmm037176. https://doi.org/10.1242/dmm.037176
34. Amar S., Smith L., Fields G. B. Matrix metalloproteinase collagenolysis in health and disease. Biochim. Biophys. Acta Mol. Cell. Res. 2017;1864(11 Pt A):1940-1951. https://doi.org/10.1016/j.bbamcr.2017.04.015
35. Xu S., Xu H., Wang W., Li S., Li H. [et al.]. The role of collagen in cancer: from bench to bedside. J. Transl. Med. 2019;17(1):309. https://doi.org/10.1186/s12967-019-2058-1
36. DiChiara A. S., Li R. C., Suen P. H., Hosseini A. S., Taylor R. J. [et al.]. A cysteine-based molecular code informs collagen C-propeptide assembly. Nat. Commun. 2018;9(1):4206. https://doi.org/10.1038/s41467-018-06185-2
37. Toba H., de Castro Brás L. E., Baicu C. F., Zile M. R., Lindsey M. L., Bradshaw A. D. Increased ADAMTS1 mediates SPARC-dependent collagen deposition in the aging myocardium. Am. J. Physiol. Endocrinol. Metab. 2016;310(11):E1027-E1035. https://doi.org/10.1152/ajpendo.00040.2016
38. Boote C., Palko J. R., Sorensen T., Mohammadvali A., Elsheikh A. [et al.]. Changes in posterior scleral collagen microstructure in canine eyes with an ADAMTS10 mutation. Mol. Vis. 2016;22:503-517.
39. Exposito J. Y., Valcourt U., Cluzel C., Lethias C. The fibrillar collagen family. Int. J. Mol. Sci. 2010;11(2):407-426. https://doi.org/10.3390/ijms11020407
40. Chow W. Y., Forman C. J., Bihan D., Puszkarska A. M., Rajan R. [et al.]. Proline provides site-specific flexibility for in vivo collagen. Sci. Rep. 2018;8(1):13809. https://doi.org/10.1038/s41598-018-31937-x
41. Albaugh V. L., Mukherjee K., Barbul A. Proline Precursors and Collagen Synthesis: Biochemical Challenges of Nutrient Supplementation and Wound Healing. J. Nutr. 2017;147(11):2011-2017. https://doi.org/10.3945/jn.117.256404
42. Spodenkiewicz M., Spodenkiewicz M., Cleary M., Massier M., Fitsialos G. [et al.]. Clinical Genetics of Prolidase Deficiency: An Updated Review. Biology (Basel). 2020;9(5):108. https://doi.org/10.3390/biology9050108
43. Karna E., Szoka L., Huynh T. Y. L., Palka J. A. Prolinedependent regulation of collagen metabolism. Cell. Mol. Life Sci. 2020;77(10):1911-1918. https://doi.org/10.1007/s00018-019-03363-3
44. Lu Y., Zhang S., Wang Y., Ren X., Han J. Molecular mechanisms and clinical manifestations of rare genetic disorders associated with type I collagen. Intractable Rare Dis. Res. 2019;8(2):98-107. https://doi.org/10.5582/irdr.2019.01064
45. Fidler A. L., Boudko S. P., Rokas A., Hudson B. G. The triple helix of collagens – an ancient protein structure that enabled animal multicellularity and tissue evolution. J. Cell. Sci. 2018;131(7):jcs203950. https://doi.org/10.1242/jcs.203950
46. Pullar J. M., Carr A. C., Vissers M. C. M. The Roles of Vitamin C in Skin Health. Nutrients. 2017;9(8):866. https://doi.org/10.3390/nu9080866
47. Kalamajski S., Bihan D., Bonna A., Rubin K., Farndale R. W. Fibromodulin Interacts with Collagen Cross-linking Sites and Activates Lysyl Oxidase. J. Biol. Chem. 2016;291(15):7951-7960. https://doi.org/10.1074/jbc.M115.693408
48. Padayatty S. J., Levine M. Vitamin C: the known and the unknown and Goldilocks. Oral Dis. 2016;22(6):463-493. https://doi.org/10.1111/odi.12446
49. Kanta J. Collagen matrix as a tool in studying fibroblastic cell behavior. Cell. Adh. Migr. 2015;9(4):308-316. https://doi.org/10.1080/19336918.2015.1005469
50. Zitnay J. L., Li Y., Qin Z., San B. H., Depalle B. [et al.]. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nat. Commun. 2017;8:14913. https://doi.org/10.1038/ncomms14913
51. Tong T., Park J., Moon Y., Kang W., Park T. α-Ionone Protects Against UVB-Induced Photoaging in Human Dermal Fibroblasts. Molecules. 2019;24(9):E1804-1826. https://doi.org/10.3390/molecules24091804
52. Cheong M. L., Lai T. H., Wu W. B. Connective tissue growth factor mediates transforming growth factor β-induced collagen expression in human endometrial stromal cells. PLoS One. 2019;14(1):e0210765. https://doi.org/10.1371/journal.pone.0210765
53. Plou J., Juste-Lanas Y., Olivares V., Del Amo C., Borau C., García-Aznar J. M. From individual to collective 3D cancer dissemination: roles of collagen concentration and TGF-ß. Sci. Rep. 2018;8(1):12723. https://doi.org/10.1038/s41598-018-30683-4
54. Shin J. W., Kwon S. H., Choi J. Y., Na J. I., Huh C. H. [et al.]. Molecular Mechanisms of Dermal Aging and Antiaging Approaches. Int. J. Mol. Sci. 2019;20(9):2126. https://doi.org/10.3390/ijms20092126
55. Nigdelioglu R., Hamanaka R. B., Meliton A. Y., O’Leary E., Witt L. J. [et al.]. Transforming Growth Factor (TGF)-β Promotes de Novo Serine Synthesis for Collagen Production. J. Biol. Chem. 2016;291(53):27239-27251. https://doi.org/10.1074/jbc.M116.756247
56. Castiglioni S., Leidi M., Carpanese E., Maier J. A. Extracellular magnesium and in vitro cell differentiation: different behaviour of different cells. Magnes Res. 2013;26(1):24-31. https://doi.org/10.1684/mrh.2013.0330
57. Orth M., Averina M., Chatzipanagiotou S., Faure G., Haushofer A. [et al.]. Opinion: redefining the role of the physician in laboratory medicine in the context of emerging technologies, personalised medicine and patient autonomy (‘4P medicine’). J. Clin. Pathology. 2019;72(3):191-197. https://doi.org/10.1136/jclinpath-2017-204734

