Бизер Маргарита Богдановна, врач-дерматолог, косметолог, ООО «БиоЭстетика» Москва
Управлением по контролю качества пищевых продуктов и лекарственных препаратов США (FDA) 21 год назад, в 2002 г., было одобрено применение филлеров на основе стабилизированной гиалуроновой кислоты (ГК) с целью омоложения и устранения дисгармоний лица [1]. С тех пор количество процедур с использованием стабилизированной ГК неуклонно растет. По данным ASAPS (Американское общество эстетических пластических хирургов), только за 2017 г. на территории США было проведено более 1,3 млн инъекций филлеров на основе стабилизированной ГК. За эти 21 год стабилизированная ГК показала себя как один из самых безопасных и минимально иммуногенных наполнителей. Но главным ее преимуществом считают наличие антидота – фермента гиалуронидазы, что и позволило филлерам на основе стабилизированной ГК занять лидирующие позиции среди всех биодеградируемых наполнителей на рынке эстетической медицины.
Впечатляющее число проведенных инъекций, расширение показаний и зон коррекции, появление новых препаратов и использование их больших объемов, наслаивание филлеров разных торговых марок и длительная повторная терапия – все это требует обновления клинических рекомендаций для профилактики и лечения осложнений, возникающих после проведения процедур контурной инъекционной пластики (КИП) [2–4]. Rohrichet с соавт. предложил подразделять осложнения на ранние, поздние и отсроченные [5], но некоторые авторы предлагают иную классификацию [5]:
– немедленные осложнения, возникающие в течение 24 часов после проведения процедуры КИП;
– ранние, возникающие от 24 часов до 4 недель после процедуры КИП;
– отсроченные, возникающие спустя 4 недели и до 1 года после проведенной процедуры.
Ранняя инфекция обычно напрямую связана с нарушением правил асептики и антисептики, а также несоблюдением пациентом общих рекомендаций после проведенной процедуры [6] и чаще всего вызывается Staphylococcus aureus и
Streptococcus pyogenus [7]. Поздняя же инфекция, возникающая спустя четыре недели после процедуры, с большей вероятностью связана с формированием бактериальной биопленки, появляющейся вследствие загрязнения филлера
Staphylococcus epidеrmidis, Staphylococcus aureus и P.acnes [5, 8].
В связи с появлением новой концепции о биопленке поздние осложнения воспалительного характера получили название воспалительной гранулемы инородного тела (ВГИТ) [9, 10].
Сообщалось, что даже незначительное загрязнение ГК бактериями достаточно для развития биопленки [11]. Было показано, что пациенты с отсроченными воспалительными осложнениями имели бактериальную флору кожи с преобладанием потенциально патогенных бактерий [9].
К факторам, способствующим возникновению биопленки, следует отнести любые воспаления кожи, травмы, инфекции периодонта и синуситы [12, 13]. В мировой литературе сообщалось о связи между определенными факторами образа жизни и риском возникновения отсроченных бактериальных осложнений [12, 14]. Было отмечено, что пациенты, ведущие активный образ жизни, посещающие бассейны, сауны, тренажерные залы, имеющие домашних животных, принимающие гормональную заместительную терапию в постклимактерическом периоде, а также те, кто не принимал антибиотикотерапию в последние 12 месяцев после КИП, менее подвержены отсроченным воспалительным осложнениям [10]. Это связано с поддержанием общего иммунитета и разнообразием физиологической микрофлоры.
Биопленка представляет собой совокупность бактерий одного или нескольких штаммов, прикрепленных друг к другу в трехмерной структуре на поверхности наполнителя, который является инородным телом (имплантатом) в подкожно-ировой клетчатке [8]. Толщина биопленки варьирует от 5 до 1200 мкм, что весомо затрудняет взятие образцов для микробиологического метода культивирования и ведет к ложноотрицательным результатам исследования [15, 16]. Снаружи она покрыта полимерным матриксом – гликокаликсом, который защищает ее от иммунных клеток и способствует антибиотикорезистентности [8, 17].
Сформировавшиеся биопленки могут годами находиться в состоянии покоя [18, 19]. Активация же инфекции может быть вызвана ятрогенными манипуляциями, травмой, снижением общего иммунитета, обострением хронических заболеваний. В анамнезе пациентов с ВГИТ эндодонтические и косметологические процедуры, герпесвирусные инфекции, а также острые респираторные заболевания были описаны за несколько дней до появления первых симптомов [13].
Симптоматика
Первичными жалобами пациентов будут отечность, гиперемия, уплотнение тканей и болезненность в зоне введения филлера [5, 9, 20]. Если на начальном этапе не проводится надлежащая терапия, могут образовываться свищи и фистулы с гнойным содержимым [5, 9, 10, 13, 20]. Ложноотрицательные по культуре микробиологические исследования воспринимаются многими специалистами как аллергическая реакция по замедленному типу, что приводит к назначению антигистаминных и стероидных препаратов, усугубляющих клиническую картину [20]. Основными аргументами в пользу ВГИТ являются признаки воспаления (отек, гиперемия, болезненность и местное повышение температуры тканей в области введения имплантата), длительный период времени (от четырех недель до нескольких лет) после КИП, а также неэффективность стероидной терапии [5]. В пользу бактериальной биопленки будет говорить резистентность ко многим антибактериальным препаратам [9, 20, 21].
Таким образом, отсроченные инфекции, связанные с биопленкой, напоминают хронические рецидивирующие заболевания, устойчивые к обычному лечению антибактериальными препаратами, и могут привести к обезображиванию пациента.
В связи с этим в 2014 г. ESCMID (Европейское общество клинической микробиологии и инфекционных заболеваний) дало следующие рекомендации по лечению инфекций, связанных с имплантацией инородного тела [5]:
1) обширная антибиотикотерапия должна включать как минимум два препарата, направленных против грамположительных и грамотрицательных штаммов;
2) длительность антибактериальной терапии минимум три недели;
3) удаление зараженного имплантата (его сохранение возможно при положительной клинической картине после антибиотикотерапии и отсутствии рецидивов в течение последующих двух лет).
Основываясь на этих рекомендациях, в 2019 г. Wojciech Marusza и Irina Netsvyetayeva предложили так называемую M&N-терапию [20].
M&N-терапия
M&N-терапия включает в себя:
1) санацию гнойного содержимого и остатков сшитой ГК 2 раза в неделю до полного разрешения (при наличии гнойного содержимого следует направить пациента на консультацию к челюстно-лицевому хирургу);
2) комбинированную антибиотикотерапию: моксифлоксацин per os по 400 мг 2 раза в сут + кларитромицин per os по 500 мг 2 раза в сут в течение 14–21 дня, до полного разрешения клинической симптоматики;
3) местное введение гиалуронидазы в очаг поражения 2 раза в неделю до полного разрешения клинической симптоматики. Следует отметить, что перед введением фермента гиалуронидазы необходим тест на аллергическую реакцию (введение подкожно 20 Ед гиалуронидазы с последующим наблюдением в течение 30 мин). Результаты теста следует оценивать спустя 72 часа. Также перед введением фермента в очаг поражения следует убедиться при помощи УЗ-диагностики в отсутствии гнойного содержимого;
4) терапию пробиотиками.
Моксифлоксацин относится к группе фторхинолонов. В отличие от ципрофлоксацина он проникает в биопленочную среду, проявляет свои бактерицидные свойства против грамположительных и грамотрицательных аэробных бактерий, а также против анаэробов [28–32].
Кларитромицин является полусинтетическим макролидом с бактерицидными свойствами в отношении грамположительных и атипичных бактерий, обладает уникальным свойством разрушать гликокаликс биопленки и уничтожать биопленочные структуры независимо от типа бактерий, которыми они образованы [23–27].
Gander S. с cоавт. сообщил, что комбинация моксифлоксацина и кларитромицина в значительной мере увеличивает деструктивное действие на биопленку [25].
Критериями положительной терапии является отсутствие симптомов бактериальной инфекции (отек, боль, гиперемия, уплотнения, флюктуация и выделение гноя) в месте введения сшитой ГК и рецидивов в течение последующих двух лет [1, 5, 20].
Ряд авторов считают, что в случае положительной терапии повторная коррекция филлерами на основе стабилизированной ГК возможна спустя два месяца [20].
Клинический случай
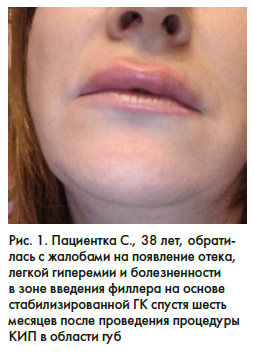
В клинику обратилась пациентка С. 38 лет с жалобами на появление отека, легкой гиперемии и болезненности в зоне введения филлера на основе стабилизированной ГК спустя шесть месяцев после проведения процедуры КИП в области губ (рис. 1). Пациентка связывает появление данных симптомов с переохлаждением. После осмотра был поставлен предварительный диагноз ГВИ (герпесвирусная инфекция) и назначено лечение:
1) валацикловир per os по схеме;
2) ацикловир мазь местно.
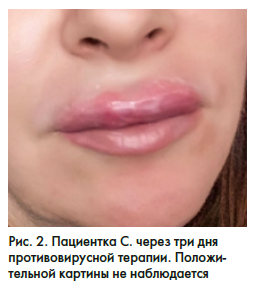
Через 3 дня противовирусной терапии пациентка, не увидев положительной клинической картины (рис. 2), обратилась в КВД по месту жительства.
Назначено следующее лечение:
1) валацикловир по схеме продолжить;
2) тетрациклин мазь местно;
3) левомеколь мазь местно чередовать;
4) ципролет 500 мг 2 раза в сут № 5;
5) бифидумбактерин форте.
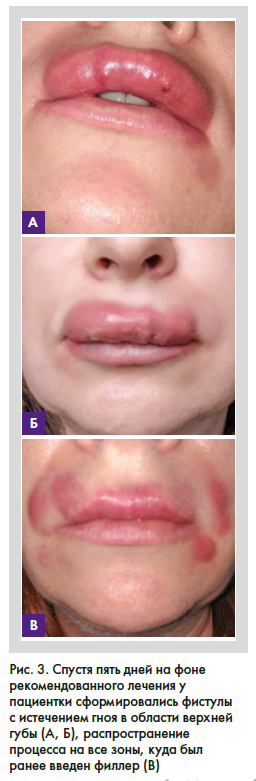
Спустя пять дней на фоне рекомендованного лечения у пациентки сформировались фистулы с истечением гноя в области верней губы, распространение процесса на все зоны, куда был ранее введен филлер (рис. 3) (области нижней
губы, носогубных складок и подкомиссурального треугольника). Поставлен диагноз ВГИТ. Рекомендована терапия по протоколу M&N:
1) моксифлоксацин per os по 400 мг
2 раза в сут + кларитромицин per os по 500 мг 2 раза в сут № 14;
2) левомеколь мазь местно;
3) бифидумбактерин форте;
4) рекомендована УЗ-диагностика периоральной области;
5) рекомендована консультация ЧЛХ.
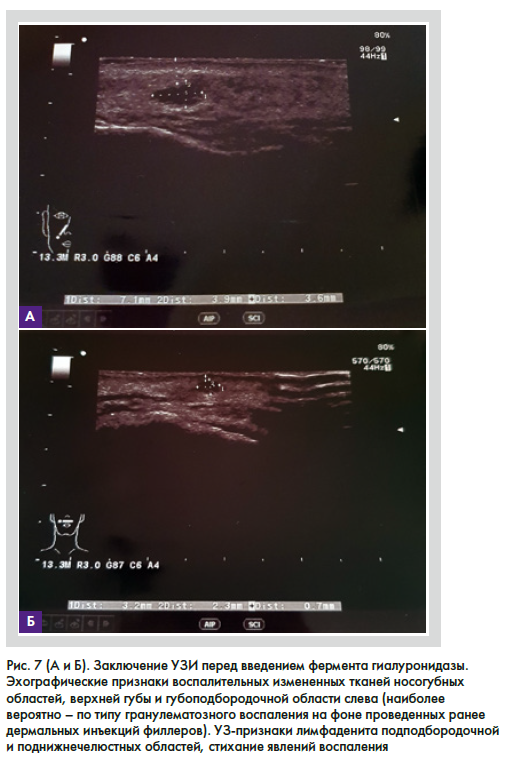
При осмотре пациентки на 4, 8 и 13-й день (рис. 4–6) рекомендуемой терапии наблюдается положительная клиническая симптоматика. По данным УЗ-диагностики на 13-й день лечения (рис. 7): эхографические признаки воспалительных измененных тканей носогубных областей, верхней губы и губоподбородочной области слева (наиболее вероятно, по типу гранулематозного воспаления на фоне проведенных ранее инъекций дермальных филлеров). УЗ-признаки лимфаденита подподбородочной и поднижнечелюстных областей, стихание явлений воспаления.
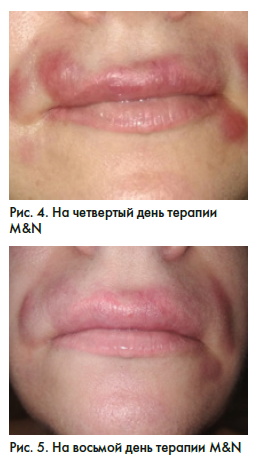
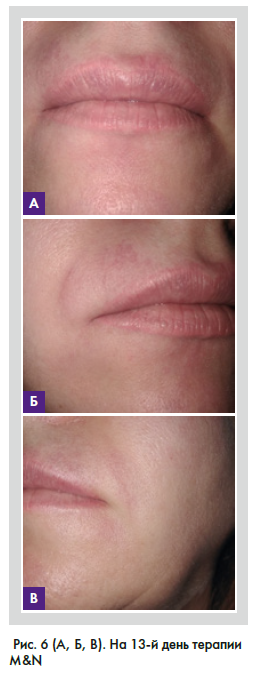
На 14-й день терапии было принято решение о введении фермента гиалуронидазы и продлении антибиотикотерапии до 21 дня (рис. 8).

И в заключение
И в заключение хочется сказать, что ВГИТ может возникнуть при любом кожном наполнителе, и на 100% никто не застрахован от этого тяжелого осложнения. Подробный сбор анамнеза пациента, выявление и лечение сопутствующих заболеваний еще до проведения КИП, соблюдение правил асептики и антисептики, а также рекомендаций по реабилитационному периоду и образу жизни пациентов после проведенной процедуры контурной инъекционной пластики поможет таких случаев избежать.
ЛИТЕРАТУРА
[1] Dinu I. Dumitra Şcu and Alexandru V. Georgescu. The management of biofilm formation after hyaluronic acid gel filler injections: a review Clujul Med. 2013; 86(3): 192–195.
[2] De Boulle K., Heydenrych I. Patient factors influencing dermal filler complications: prevention, assessment, and treatment. Clin CosmetInvestig Dermatol. 2015; 8: 205–214.
[3] Ferneini E.M., Ferneini A.M. An overview of vascular adverse events associated with facial soft tissue fillers: recognition, prevention, and treatment. J Oral Maxillofac Surg. 2016; 74(8): 1630–1636.
[4] Chiang Y.Z., Pierone G., Al-Niaimi F. Dermal fillers: pathophysiology, prevention and treatment of complications. J Eur Acad Dermatol Venereol 2016.
[5] Urdiales-Gálvez F., Delgado N.E., Figueiredo V., Lajo-Plaza J.V., Mira M., Moreno A., rtíz-Martí F., Del Rio-Reyes R., Romero-Álvarez N., Del Cueto S.R., Segurado M.A. and Rebenaque C.V.. Treatment of Soft Tissue Filler Complications: Expert Consensus Recommendations Aesthetic Plast Surg. 2018; 42(2): 498–510.
[6] Funt D., Pavicic T. Dermal fillers in aesthetics: an overview of adverse events and treatment approaches. Clin CosmetInvestig Dermatol. 2013; 6: 295–316.
[7] Urdiales-Gálvez F, Delgado N, Figueiredo V, et al. Treatment of soft tissue filler complications: expert consensus recommendations. Aesthetic Plast Surg. 2018; 42(2): 498–510.
[8] Sathianathan M., Hegde A., Vickery K., Deva A.K. The role of biofilm in hyaluronic acid filler: an in vitro study. PlastReconstr Surg. 2013; 132(4S-1): 100–101.
[9] Netsvyetayeva I., Marusza W., Olszanski R., et al. Skin bacterial flora as a potential risk factor predisposing to late bacterial infection after cross-linked hyaluronic acid gel augmentation. Infect Drug Resist. 2018; 11: 213–222.
[10] Marusza W., Olszanski R., Sierdzinski J., Szyller K., Ostrowski T., Gruber-Miazga J. and Netsvyetayeva I. The impact of lifestyle upon the probability of late bacterial infection after soft-tissue filler augmentation 2019; Infect Drug Resist. 12: 855–863.
[11] Alhede M., Er O., Eickhardt S., et al. Bacterial biofilm formation and treatment in soft tissue fillers. Pathog Dis. 2014; 70(3): 339–346.
[12] Flandroy L., Poutahidis T., Berg G., et al. The impact of human activities and lifestyles on the interlinked microbiota and health of humans and of ecosystems. Sci Total Environ. 2018; 15(627): 1018–1038.
[13] Marusza W., Mlynarczyk G., Olszanski R., et al. Probable biofilm formation in the cheek as a complication of soft tissue filler resulting from improper endodontic treatment of tooth 16. Int J Nanomedicine. 2012; 7: 1441–1447.
[14] Stocks D., Sundaram H., Michaels J., Durrani M.J., Wortzman M.S., Nelson D.B. Rheological evaluation of the physical properties of hyaluronic acid dermal fillers. J Drugs Dermatol. 2011; 10: 974–980.
[15] Dayan S.H., Arkins J.P., Brindise R. Soft tissue fillers and biofilms. Facial Plast Surg. 2011; 27(1): 23–28.
[16] Donald R.M., Costerton J.W. Biofilms: survival mechanism of clinically relevant microorganisms. ClinMicrobiol Rev. 2002; 15: 167–193.
[17] Lebeaux D., Chigo J.M., Belon C. Biofilm-rewlated infections: bridging the gap between clinical management and fundamental aspects of recalcitrance tonad antibiotics. Microbiol Mol Biol Rev 2014 Sep; 78(3): 510–43.
[18] Oliveira A., Cunha M. Comparison of methods for the detection of biofilm production in coagulase-negative staphylococci. BMC Res Notes. 2010; 3: 260.
[19] Morales M., Mendez-Alvarez S., Martin-Lopes J.V., Marreiro C., Freytes C.O. Biofilm: the microbial «bunker» for intravascular catheter-related infection. Support Care Cancer. 2004; 12: 701–707.
[20] Marusza W., Olszanski R., Sierdzinski J., Ostrowski T., Szyller K., Mlynarczyk G. and Netsvyetayeva I. Treatment of late bacterial infections resulting from soft-tissue filler injections Infect Drug Resist. 2019; 12: 469–480.
[21] Rothschild L.J., Mancinelli R.L. Life in extreme environments. Nature. 2001; 409: 1092–1101.
[22] Rzany B., DeLorenzi C. Understanding, avoiding, and managing severe filler complications. Plast Reconstr Surg. 2015; 136.
[23] Fujimura. S, Sato T., Hayakawa S., Kawamura M., Furukawa E., Watanabe A. Antimicrobial efficacy of combined clarithromycin plus daptomycin against biofilms-formed methicillin-resistant Staphylococcus aureus on titanium medical devices. J Infect Chemother. 2015; 21(10): 756–759.
[24] Fujimura S., Sato T., Mikami T., Kikuchi T., Gomi K., Watanabe A. Combined efficacy of clarithromycin plus cefazolin or vancomycin against Staphylococcus aureus biofilms formed on titanium medical devices. Int J Antimicrob Agents. 2008; 32(6): 481–484.
[25] Gander S., Kinnaird A., Finch R. Telavancin: in vitro activity against staphylococci in a biofilm model. J Antimicrob Chemother. 2005; 56(2): 337–343.
[26] Elkhatib W., Noreddin A. Efficacy of ciprofloxacin-clarithromycin combination against drug-resistant Pseudomonas aeruginosa mature biofilm using in vitro experimental model. Microb Drug Resist. 2014; 20(6): 575–582.
[27] Hou W., Xiao H. The eliminating effects of clarithromycin combined with ciprofloxacin on Pseudomonas aeruginosa biofilms in the middle ear mucosa of rats. Int J ClinExp Med. 2016; 9(2): 2945–2952.
[28] Parra-Ruiz J., Vidaillac C., Rose W.E., Rybak M.J. Activities of high-dose daptomycin, vancomycin, and moxifloxacin alone or in combination with clarithromycin or rifampin in a novel in vitro model of Staphylococcus aureus biofilm. Antimicrob Agents Chemother. 2010; 54(10): 4329–4334.
[29] Jacqueline C., Caillon J. Impact of bacterial biofilm on the treatment of prosthetic joint infections. J Antimicrob Chemother. 2014; 69 (Suppl 1): i37–i40.
[30] San Juan R., Garcia-Reyne A., Caba P, et al. Safety and efficacy of moxifloxacin monotherapy for treatment of orthopedic implantrelated staphylococcal infections. Antimicrob Agents Chemother. 2010; 54(12): 5161–5166.
[31] Swidsinski A., Dörffel Y., Loening-Baucke V., Schilling J., Mendling W. Response of Gardnerella vaginalis biofilm to 5 days of moxifloxacin treatment. FEMS Immunol Med Microbiol. 2011; 61(1): 41–46.
[32] Guay D.R. Moxifloxacin in the treatment of skin and skin structure infections. Ther Clin Risk Manag. 2006; 2(4): 417–434.
