ВВЕДЕНИЕ
При разработке технологии производства медицинских изделий для косметического применения линейки Repart® компания «ИНГАЛ» рассматривала устоявшуюся технологию производства препаратов на основе гиалуроновой кислоты (ГК), используемую большинством компаний – производителей медицинских изделий, фармацевтических и косметических препаратов.
СУЩЕСТВУЮЩИЕ СТАНДАРТНЫЕ ТЕХНОЛОГИИ ПРОИЗВОДСТВА ПРЕПАРАТОВ НА ОСНОВЕ ГИАЛУРОНОВОЙ КИСЛОТЫ
Основная по длительности стадия стандартной формализованной технологии производства препаратов на основе гиалуроновой кислоты – растворение исходной субстанции в буферном растворе. Длительность набухания полимера и его перехода в растворенное состояние может составлять от 3 до 24 часов – в зависимости от молекулярной массы исходной гиалуроновой кислоты и интенсивности перемешивания [1]. Значительное время, необходимое для получения однородного полупродукта, обосновывают возрастающей при растворении активного вещества вязкостью раствора и его упругими характеристиками – способностью эффективно поглощать распространяемые в объеме механические колебания. После перехода в растворенное состояние первых 30–40% активной субстанции скорость сдвига на границе раздела фаз твердое тело/раствор значительно снижается, а глубина распространения механических колебаний в растворе за счет вязкоупругих характеристик ГК снижается до 2–3 см.
Таким образом, скорость процесса растворения ограничивается:
– переносом молекул полимера из области с высокой концентрацией в область с более низкой концентрацией;
– удалением молекул полимера из области растворения вблизи раздела фаз в объем раствора.
Другими словами, процесс растворения гиалуроновой кислоты в буферном растворе при применении стандартной технологии оказывается диффузионно-ограниченным.
Большинство производителей инъекционных гелей используют технологии с длительной стадией растворения и медленным перемешиванием. Некоторые отказываются от термической стерилизации готового продукта в желании сохранить полезные характеристики препарата, так как:
– при повышении скорости перемешивания в растворе возрастает кумуляция тепла, объясняемая переводом механической энергии в тепловую;
– при терминальной стерилизации готового изделия происходит его нагревание до температуры выше 110° С;
– при повышении температуры раствора возрастает скорость деполимеризации ГК, приводящей к необратимой потере качественных характеристик готовой продукции.
Однако необходимо отметить существенные недостатки стандартного технологического подхода. Доступные для производителей в настоящее время исходные субстанции ГК – природная животного происхождения и биоинженерная бактериального происхождения – даже в очищенном виде имеют присущее технологическому процессу остаточное содержание нативной микрофлоры. Из-за использования нестерильной исходной субстанции и длительного времени растворения в процессе приготовления инъекционного геля происходит значительный рост числа микроорганизмов.
Для предотвращения попадания микроорганизмов в раствор полупродукта в некоторых случаях производители предварительно подвергают субстанцию ГК термической, химической или радиационной стерилизации.
Радиационная стерилизация исходной субстанции требует установления однородности поглощенной дозы, способна приводить к разрушению полимерной цепи, образованию боковых цепей и участков сшивки цепей полимера, т.е. к изменению вязкоэластических характеристик продукта.
Химическая стерилизация полимера газами, воздействующими на микрофлору, требует однородности гранулометрического состава порошка и точного подбора времени экспозиции. При недостаточной обработке возможна неполная гибель микроорганизмов, при избыточной – сорбция в препарат химических компонентов стерилизующей смеси.
Термическая стерилизация субстанции гиалуроновой кислоты приводит к накоплению термического стресса и разрушению полимерной цепи [2].
Вследствие внутрисерийной и межсерийной неоднородности гранулометрического состава и соотношения объем/поверхность используемого порошка полимера для каждого из приведенных методов достаточно сложно установить точные условия проведения стерилизации, гарантирующие одинаковые накапливаемые изменения в каждой обрабатываемой серии субстанции. Все методы стерилизации исходной субстанции гиалуроновой кислоты приводят к росту межсерийной неоднородности основных вязкоэластических характеристик получаемого готового продукта.
Существующие источники гиалуроновой кислоты – материалы животного происхождения и субстанции бактериального происхождения – объединяет наличие в их составе регуляторов обращения гиалуроновой кислоты – ферментов группы гиалуронидаз, присутствующих в клеточной стенке большинства клеток. Помимо естественного присутствия некоторое количество ферментного комплекса может быть добавлено в процессе производства субстанции для доведения молекулярной массы выделяемой фракции до целевых значений.
Разрушение комплекса гиалуронидаз происходит при стандартных для белковых молекул условиях – повышении температуры, изменении рН или радиационном облучении [3]. Вследствие того что описанные процессы также оказывают деструктивное воздействие на основной полимер, а для гарантированной полноты разрушения гиалуронидазы требуется длительное воздействие, данную технологическую операцию многие производители исходного сырья
опускают, инактивируя комплекс гиалуронидазы снижением температуры хранения ГК.
При использовании стандартного технологического подхода к производственному процессу отсутствие длительной термической или радиационной обработки исходной субстанции или термической обработки готового изделия приводит к тому, что ферментный комплекс сохраняет свою активность и попадает в готовый продукт. Оставаясь в готовом изделии, гиалуронидаза, которая не расходуется при взаимодействии, последовательно разрушает полимер в растворе, снижая вязкоэластические характеристики продукта во время хранения.
Таким образом, препараты на основе гиалуроновой кислоты, производимые с применением стандартного технологического подхода, имеют следующие основные недостатки:
– межсерийную неоднородность готового продукта по вязкоэластическим характеристикам;
– снижение характеристик готового продукта во время хранения (из-за нахождения в готовом продукте остаточного количества гиалуронидазы);
– риск контаминации отдельных упаковок микроорганизмами (вследствие отсутствия терминальной стерилизации).
НОВЕЙШИЙ СПОСОБ МОДУЛИРОВАНИЯ СВОЙСТВ ГК С ПОМОЩЬЮ ПОЛИЭТИЛЕНГЛИКОЛЯ
Компания «ИНГАЛ» смогла произвести продукт, свободный от недостатков препаратов сравнения, произведенных по стандартной технологии. При этом нам удалось, не усложняя технологического решения, сократить время на выполнение основных производственных операций благодаря внедрению современных инженерных подходов и использованию производственного оборудования, не имеющего аналогов в России и других странах. Это позволило нам перевести растворение ГК в область сверхвысоких скоростей сдвига, при которых кумуляция эластической деформации настолько велика, что релаксация и сопротивление деформации практически отсутствуют, что приводит к значительному снижению наблюдаемой вязкости системы и отражается в увеличении локальной скорости перемешивания и ускорении процесса перехода гиалуроновой кислоты из твердого состояния в растворенное. При этом время перехода ГК в растворенное состояние составляет от 15 до 45 минут, что зависит от концентрации и молекулярной массы исходного полимера.
Полученное сокращение времени на основные технологические операции и отказ от термической обработки исходной субстанции значительно уменьшили величину кумулируемого полупродуктом термального стресса, а также открыли возможность введения стадии терминальной стерилизации готового продукта в первичной упаковке.
Перечислим преимущества терминальной стерилизации в первичной упаковке:
– термическая стерилизация химически и физически однородных систем (растворов) представляет собой хорошо управляемый контролируемый процесс, позволяющий достигнуть высокой воспроизводимости параметров конечного продукта от серии к серии;
– термическая денатурация сольватированного фермента протекает быстрее, что исключает риск нахождения остаточных количеств гиалуронидазы в готовом продукте и способствует сохранению его характеристик в течение всего времени хранения;
– отсутствует риск случайной контаминации отдельных упаковок препарата микроорганизмами из-за нарушения асептических условий производства, благодаря чему возрастает однородность микробиологических характеристик препарата.
Применение полиэтиленгликоля (ПЭГ) в процессе производства инъекционного геля Repart® PG позволяет модулировать конечные вязкоэластические свойства изделия.
В процессе многократного прохождения через узел смешения при высокой скорости сдвига происходит изменение конформации молекул биополимера. Макромолекула натрия гиалуроната вытягивается, принимая линейную конфигурацию; одновременно происходит разрушение нековалентных внутримолекулярных связей [4]. В присутствии полиэтиленгликоля в молекулах натрия гиалуроната протекают конкурентные процессы рекомбинации
внутримолекулярных связей и образования межмолекулярных связей натрия гиалуроната с полиэтиленгликолем. Вязкость и упругость получаемого геля нарастают в процессе релаксации и по истечении 48 часов значительно превышают вязкость и упругость геля, получаемого медленным растворением субстанции, благодаря контакту между цепями полимера, который устанавливают молекулы полиэтиленгликоля.
При этом за счет отсутствия ковалентных межмолекулярных связей ПЭГ снижает упругость изделия при высоких напряжениях сдвига [5], облегчая извлечение изделия через иглу малого диаметра.
Благодаря своей текучести под давлением интрадермальный имплантат Repart® PG равномерно распределяется в кожных тканях. К тому же, обладая характерными для инъекционных гелей гиалуроновой кислоты выраженными вязкоэластическими свойствами, дополнительно усиленными стабилизацией цепей полимера поперечной сшивкой полиэтиленгликолем, имплантат сохраняет форму, приобретенную при введении.
По данным Международной энциклопедии по токсикологии [6], полиэтиленгликоль имеет очень низкую степень токсичности и не является канцерогеном. Всемирная организация здравоохранения определила максимально допустимую дозу потребления ПЭГ в сутки, которая составляет 10 мг/кг массы человека [7]. При парентеральном введении полиэтиленгликоля полулетальная доза (LD 50) для мышей составляет 18 г/кг массы тела, для крыс – 16 г/кг массы тела, что характеризует этот полимер как более безопасный, чем сама гиалуроновая кислота. LD 50 гиалуроновой кислоты для мышей и крыс составляет 4 г/кг массы тела [8]. При введении 2 мл Repart® PG человек получает за один сеанс дозу ПЭГ, не превышающую 0,013 мг, что с учетом вышеприведенных данных ничтожно мало.
Внедрение новых усовершенствованных технологий привело к повышению качественных характеристик готового изделия и введению в рецептуру полиэтиленгликоля, что дало возможность получить уникальный продукт, в значительной степени отличающийся от уже существующих. Состав скинбустера Repart® PG представлен гиалуронатом натрия (молекулярной массой 3 МДа в концентрации 2,2%), стабилизированным ПЭГ. Такая комбинация полимеров позволила добиться высокой устойчивости гиалуроновой кислоты к биоферментированию со стороны гиалуронидаз кожной ткани человека, повышения реологических свойств и лучшей диффузионной способности вводимого геля непосредственно в мягких тканях. Это отразилось на ряде параметров клинического применения медицинского изделия:
– сокращении длительности процедуры до 10 минут и кратности назначаемых сеансов;
– увеличении интервалов между ними;
– возможности инъекционного введения в эстетически важные точки.
Пролонгированное биоревитализирующее действие Repart® PG обеспечивает получение длительных выраженных клинических результатов, среди которых волюмизация подкожного жирового слоя, сокращение кожного лоскута и его лифтинг, повышение тургора и эластичности, улучшение цвета кожи, сокращение количества и выраженности морщин и складок различной глубины и протяженности.
Введение в тактику превентивного и коррекционного антивозрастного ухода скинбустера Repart® PG соответствует концепции социальной сохранности внешнего вида пациента, которая становится наиболее приоритетной и востребованной при обращениях в косметологические клиники на протяжении последних нескольких лет. Разработанная технология парентерального введения препарата позволяет исключить из протокола проведения
процедуры анестезирующее пособие (аппликационную анестезию), максимально устранить риск развития негативных последствий и нежелательных явлений в виде контурирующих папул, петехий и гематом.
ПРОЦЕДУРА С ПРИМЕНЕНИЕМ ИНЪЕКЦИОННОГО ГЕЛЯ REPART® PG
Основные цели и задачи применения Repart® PG:
– профилактика возрастных изменений кожи лица и тела;
– устранение признаков атрофии кожи;
– реструктуризация дермы и сокращение кожного лоскута;
– минимизация признаков гравитационного птоза I–II степени;
– выравнивание неравномерного тона и текстуры кожи;
– увеличение гидрорезерва, тургора и эластичности кожного покрова;
– комплексная коррекция постэруптивных изменений [9].
Протокол проведения процедуры с применением Repart® PG
• Очистить кожу и обработать водным антисептическим раствором, не содержащим четвертичных аммонийных солей.
• Вскрыть упаковку с медицинским изделием.
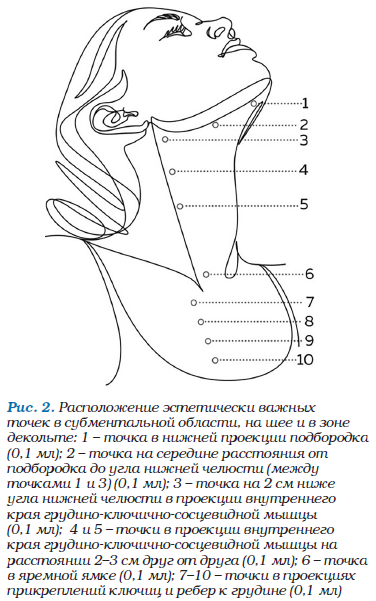
• С помощью входящих в комплект игл калибра 27 G х 13 мм выполнить глубокие дермальные инъекции в рекомендуемые точки (расположение точек (рис. 1, 2) носит рекомендательный характер и может быть изменено по усмотрению специалиста в зависимости от исходной клинической картины, морфотипа старения и поставленных конечных задач).
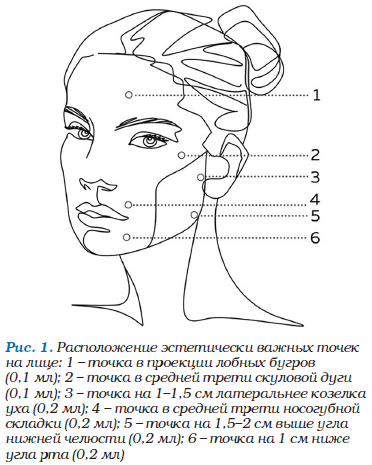
Общий объем препарата при работе с кожей лица составляет 2,0 мл.
Таким образом, общий объем препарата при работе с кожей в субментальной области, на шее и в зоне декольте также составляет 2,0 мл.
Обработать места инъекций тем же антисептическим раствором и провести легкий массаж для лучшего распределения геля и уменьшения контурирования бугорков.
Нанести успокаивающее постпроцедурное средство.
Техники введения Repart® PG: болюсная (рекомендовано), папульная, микропапульная, с помощью микроканюли.
Рекомендуемый курс: 2 процедуры с интервалом 1 месяц; количество курсов – 1–2 в год.
Поддерживающие процедуры допустимо выполнять 1 раз в 3 месяца.
КЛИНИЧЕСКИЙ СЛУЧАЙ
Пациентка Н., 56 лет. Обратилась с жалобами на усталый внешний вид, неравномерный тусклый тон кожи, темные круги вокруг глаз, морщины, провисание овала лица.
Диагноз: старческая атрофия кожи.
Лечение: курс из двух процедур Repart® PG с интервалом 1 месяц путем введения в эстетически важные точки лица и шеи в целях повышения микроциркуляции и метаболических процессов в дерме, улучшения цвета, тургора и эластичности кожи.
Результаты, которые были зафиксированы через 14 дней после первого обращения, включали: улучшение цвета кожи, умеренный лифтинг кожной ткани, уменьшение выраженности морщин в области лба, периорбитальной области и области шеи, выравнивание микротекстуры кожи и в целом значительно более свежий внешний вид (рис. 3).
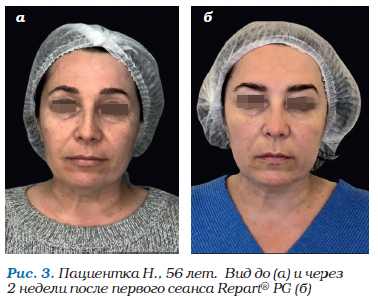
Субъективно пациентка оценила результаты проведенных мероприятий на 5 баллов из 5.
ЗАКЛЮЧЕНИЕ
Передовые технологические решения, разработанные компанией «ИНГАЛ», позволяют получать высококачественный готовый продукт на основе гиалуроновой кислоты с высокой воспроизводимостью параметров от серии к серии, низким риском контаминации полупродукта микроорганизмами, присутствием стадии терминальной стерилизации готового продукта и глубокой денатурации остаточного количества гиалуронидазы в готовом изделии.
Применение полиэтиленгликоля в производственном цикле позволяет модулировать свойства гиалуроновой кислоты, обеспечивая хорошую реологию геля, устойчивость полимера к биоферментированию после введения, что наделяет его исключительными характеристиками, обеспечивающими непревзойденные клинические результаты. Возможность инъекционного введения препарата в эстетически важные точки на лице, шее и в зоне декольте укладывается в современную концепцию социальной сохранности внешнего вида пациента. Процедура с использованием геля Repart® PG занимает не более 10 минут, не требует предварительной анестезии, не сопровождается негативными постпроцедурными явлениями, имеет малую кратность и длительные интервалы между сеансами.
ЛИТЕРАТУРА
1. Tezel A, Fredrickson GH. The science of hyaluronic acid dermal fillers. J Cosm Laser Ther, 2008;10(1):35–42.
2. Schiraldi Ch, et al. Hyaluronic acid degradation during initial steps of downstream processing. Biocatalysis and Biotransformation, 2010;28(1):83–89.
3. Ленинджер А. Основы биохимии. Пер. с англ. Т. 1. – М.:Мир, 1985.
4. Тугов ИИ, Кострыкина ГИ. Химия и физика полимеров. – М.: Химия, 1989.
5. Tirelli N, et al. Network connectivity, mechanical properties and cell adhesion for hyaluronic acid/PEG hydrogels. Biomaterials, 2011;32(27):6456–6470.
6. Enciclopedia of Toxicology. 3-d Edition. Ed. Wexler Ph. –Elsevier, 2014.
7. Codex Alimentarius. Food addative details. Updated up to the 42nd Session of the Codex Alimentarius Commission (2019). – http://www.inchem.org/documents/jecfa/jecmono/v14je19.htm.
8. Research Progress in Organic-Biological and Medicinal Chemistry. Vol. 2. Gallo G, Santamaria L (Eds). – Elsevier Science Publishing, 1970.
9. Хабаров ВН. Гиалуроновая кислота в инъекционной косметологии. – М.: ГЭОТАР-Медиа, 2017.

